Nat. Mach. Intell. | 条件生成真实抗原特异性T细胞受体序列
Nat. Mach. Intell. | 条件生成真实抗原特异性T细胞受体序列

DrugOne
发布于 2025-10-14 16:17:43
发布于 2025-10-14 16:17:43
DRUGONE
尽管近年来 T 细胞受体(TCR)工程取得了显著进展,但针对任意靶标设计功能性 TCR 依旧充满挑战,主要原因是交叉反应性的复杂规律和有限的配对数据。本研究提出了 TCR-TRANSLATE 框架,将低资源机器翻译的方法引入序列到序列建模,用于生成针对未见表位的抗原特异性 TCR 序列。研究人员系统评估了 12 种基于 BART 和 T5 架构的模型变体,揭示了性能与实用性之间的差异,并确定了关键影响因素。核心模型 TCRT5 在计算基准上优于现有方法,能够更高效地在前列位置优先排序功能相关序列。最重要的是,研究人员实验验证了一条针对 Wilms’ 肿瘤抗原的计算设计 TCR,该抗原是白血病的治疗相关靶点,并未包含在训练或验证集中。尽管该 TCR 展现出一定的病原体多肽交叉反应性,提示特异性仍有局限,但这一工作首次展示了仅凭目标序列即可在计算上设计出功能性 TCR 构建体。研究结果为计算驱动的 TCR 设计奠定了基础,并揭示了数据和方法学上的限制,为通过缩小靶标搜索空间来加速个性化免疫治疗提供了可行途径。

T 细胞通过其受体(TCR)在免疫系统中扮演“监视者”的角色。它们能够识别由主要组织相容性复合物(MHC)呈递的肽段,并以单氨基酸级别的精度区分自我与非自我。这种高度特异性的识别机制支撑了免疫防御,但同时也带来了 TCR 工程上的难题。
近年来,TCR 工程以及相关免疫疗法(如 CAR-T、工程化 TCR 以及 TCR 双特异性抗体)在慢性感染、自身免疫疾病和癌症治疗中取得突破性进展。然而,发现兼具特异性和自我耐受性的 TCR 依旧依赖于费时、低效的体外筛选。传统实验方法不仅耗费资源,而且难以覆盖广阔的 TCR–pMHC 组合空间。
计算方法为这一困境提供了希望。通过算法模拟和生成,研究人员有望在体外实验之前快速筛选候选 TCR,从而大幅提高效率。然而,现实挑战在于:数据稀疏、偏倚严重,大多数已知抗原特异性 TCR 仅限于少数疾病背景。因此,研究人员提出通过条件生成框架来直接建模 TCR 与 pMHC 的映射关系,以应对数据有限的场景。
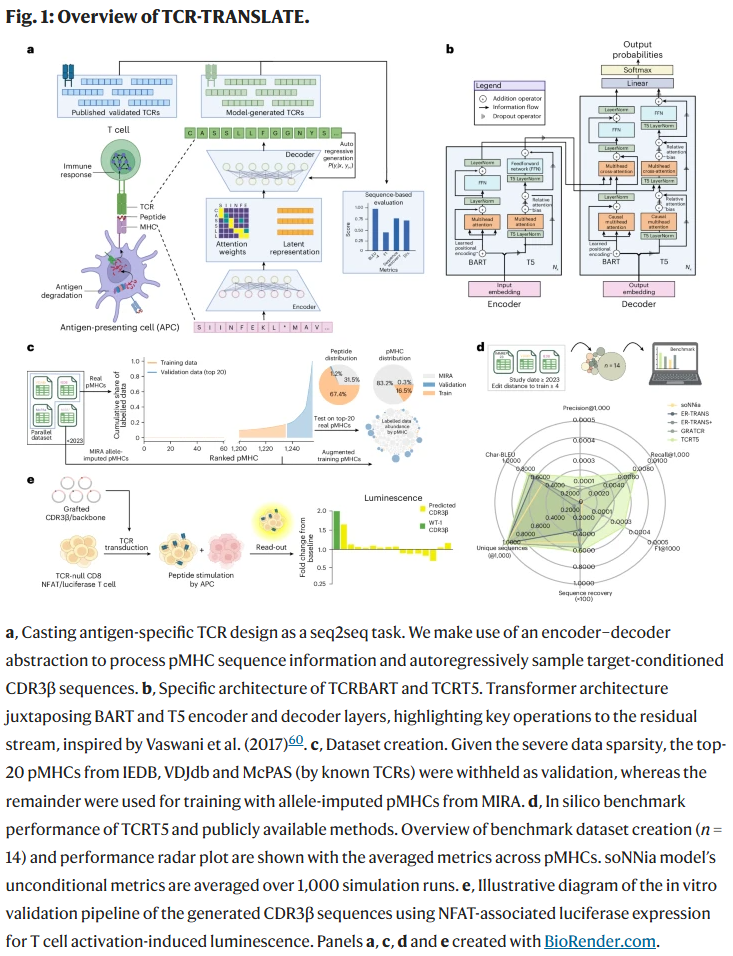
方法
研究人员将抗原特异性 TCR 的设计任务转化为一个稀疏的 序列到序列(seq2seq)问题。核心思想是:输入表位–MHC(pMHC)序列信息,模型即可输出条件生成的 TCR 序列。
具体做法包括:
- 模型架构:设计了两类基于 Transformer 的编码器–解码器架构,分别是 TCRBART 和 TCRT5。
- 训练策略:引入低资源机器翻译中的多种技巧,包括 双向建模(pMHC ↔ TCR 的相互翻译)、多任务学习(结合掩码语言建模),以弥补数据稀缺的问题。
- 数据集构建:从 IEDB、VDJdb 和 McPAS 数据库中筛选 pMHC–TCR 配对,构建训练集,并将前 20 个高丰度 pMHC 保留作为验证集。
- 推理方式:采用束搜索进行序列采样,确保生成序列具备较高的生物学合理性。
最终,研究人员选择 TCRT5-FT 作为最佳模型,在计算基准与实验验证中均展现出优势。
结果
条件生成的优势
与无条件生成模型相比,条件生成模型在所有指标上表现更好,尤其在 序列恢复率 与 F1 分数 上差距显著。这表明在输入中引入表位信息能显著提升生成序列的针对性。
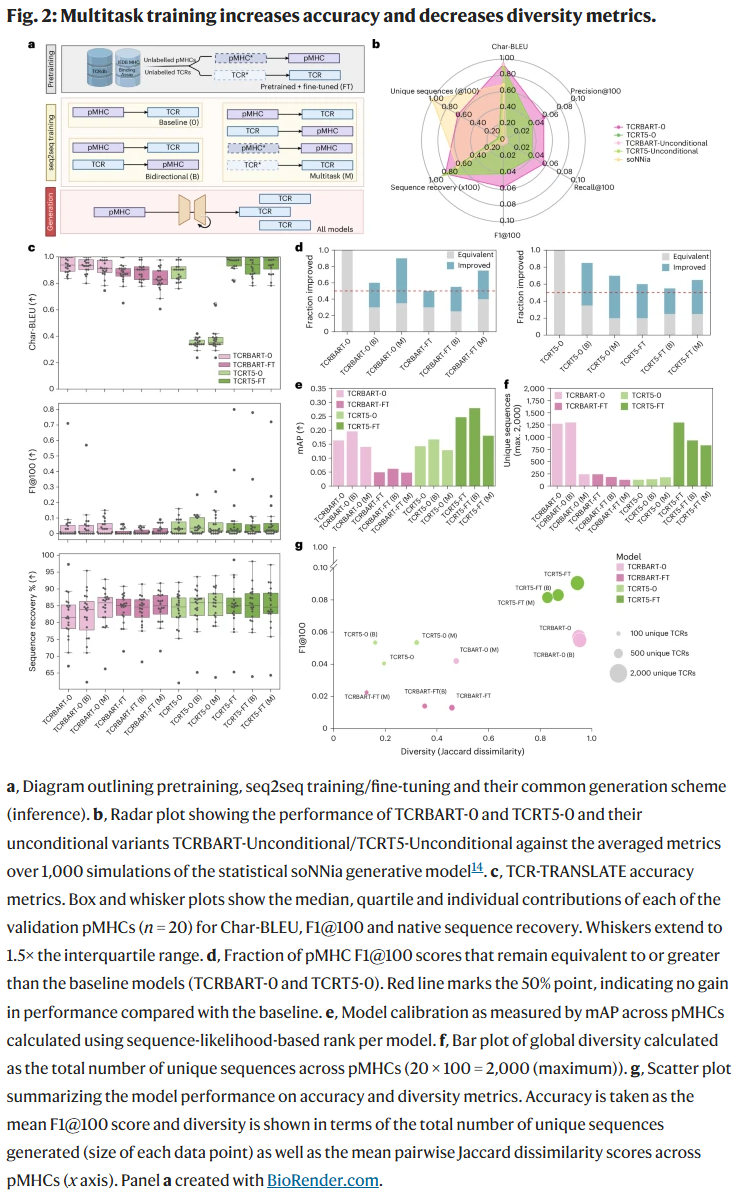
多任务训练与多特异性
多任务训练提高了模型的准确性,但减少了生成序列的多样性。研究人员发现,这类模型倾向于生成 多特异性 TCR(能够识别多个不同表位),提示其可能通过牺牲多样性来换取更高的一致性。这种现象揭示了 准确性与多样性之间的权衡。
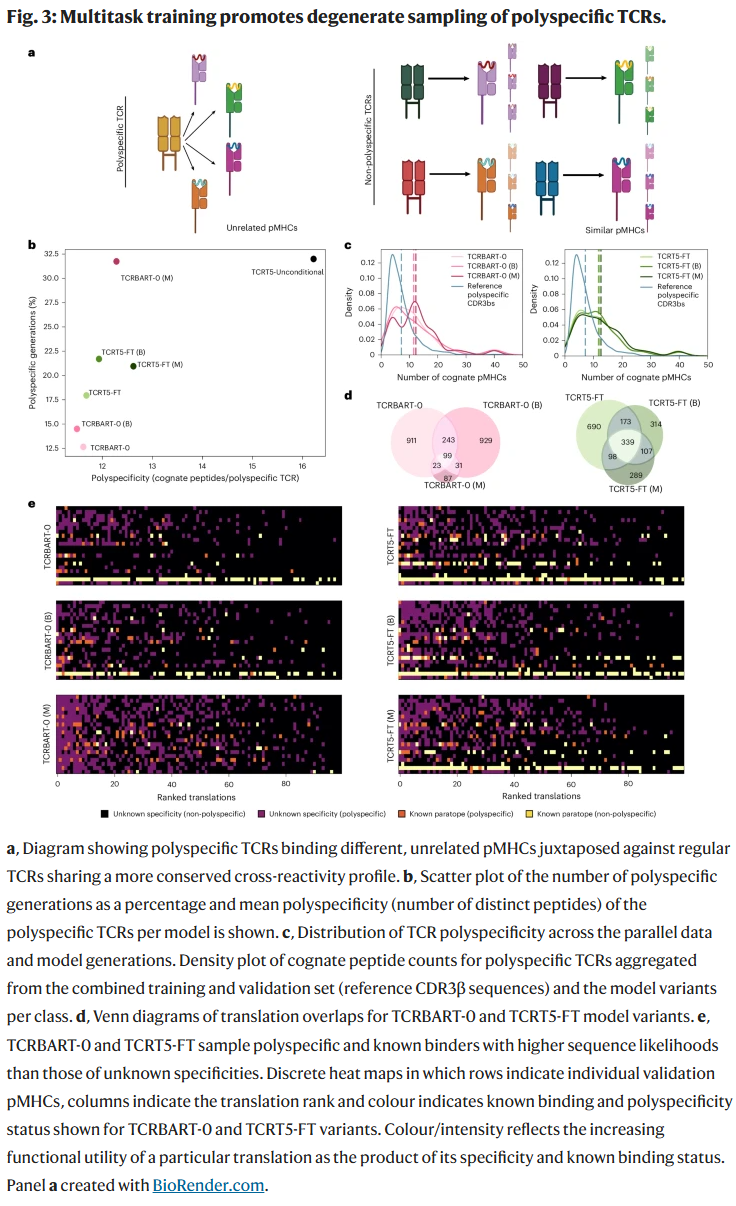
TCRT5 的表现
TCRT5 在准确性、多样性平衡及对多特异性依赖度方面表现最佳。进一步分析显示,TCRT5 能生成与真实 CDR3β 序列高度相似的序列,并捕捉到合理的长度分布和位置熵特征。其生成结果覆盖了多个病毒和肿瘤相关表位,证明其具备较强的泛化能力。
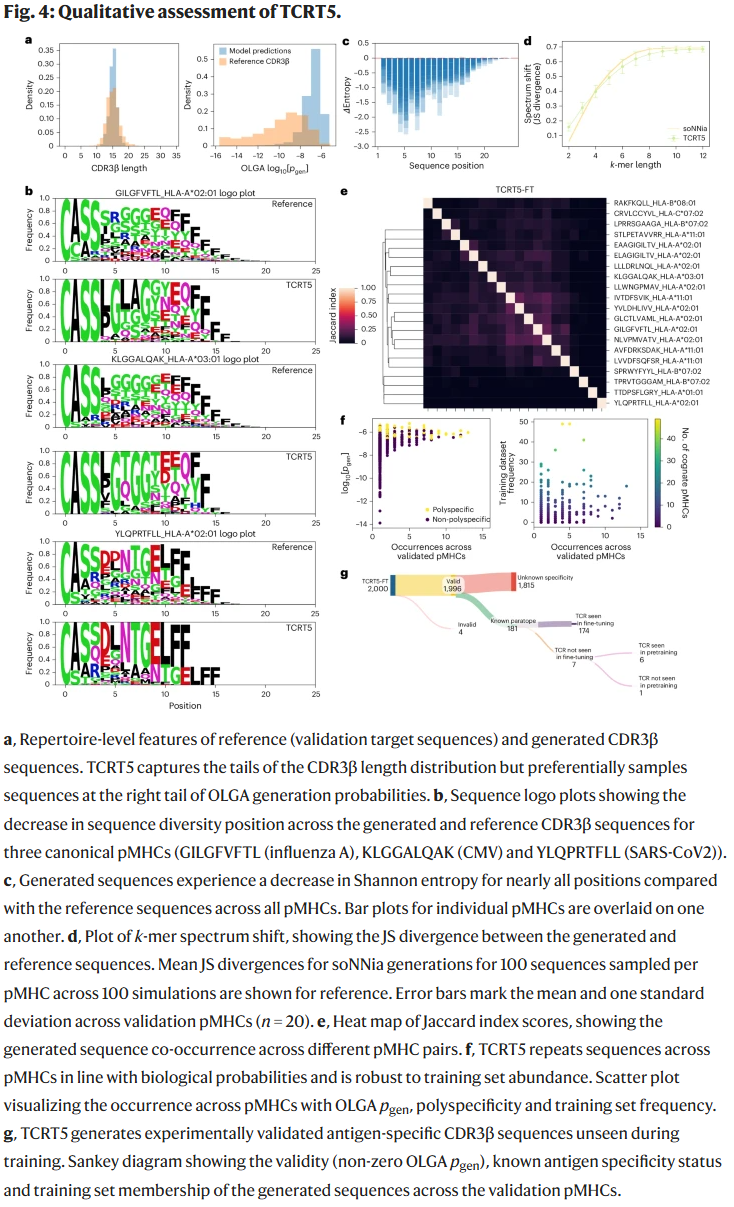
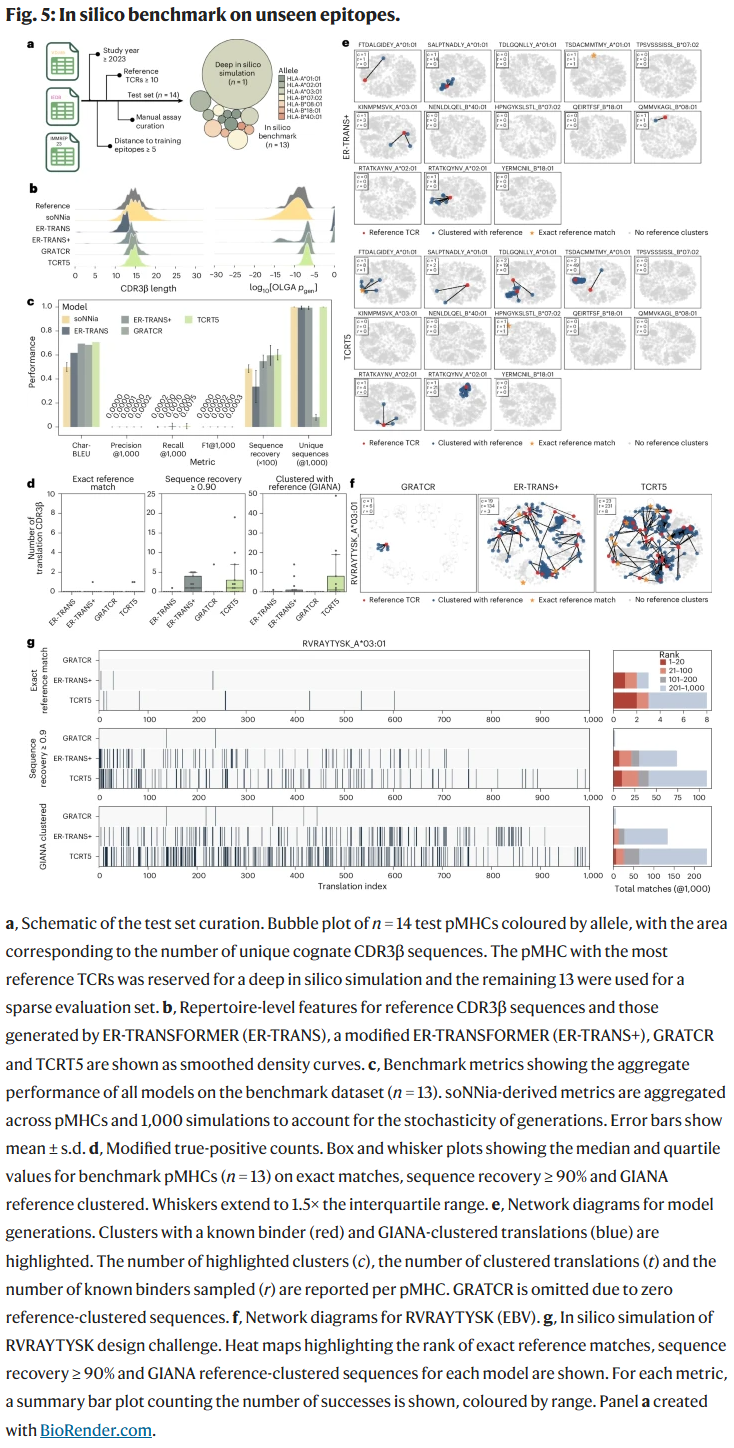
稀疏基准测试
在稀疏验证集中,TCRT5 在 精确匹配、序列相似度 和 功能聚类 等指标上均优于 ER-TRANSFORMER 和 GRATCR,并且在某些表位任务中能够恢复真实的已知结合序列。这说明 TCRT5 在极少数据条件下依然能提供可靠预测。
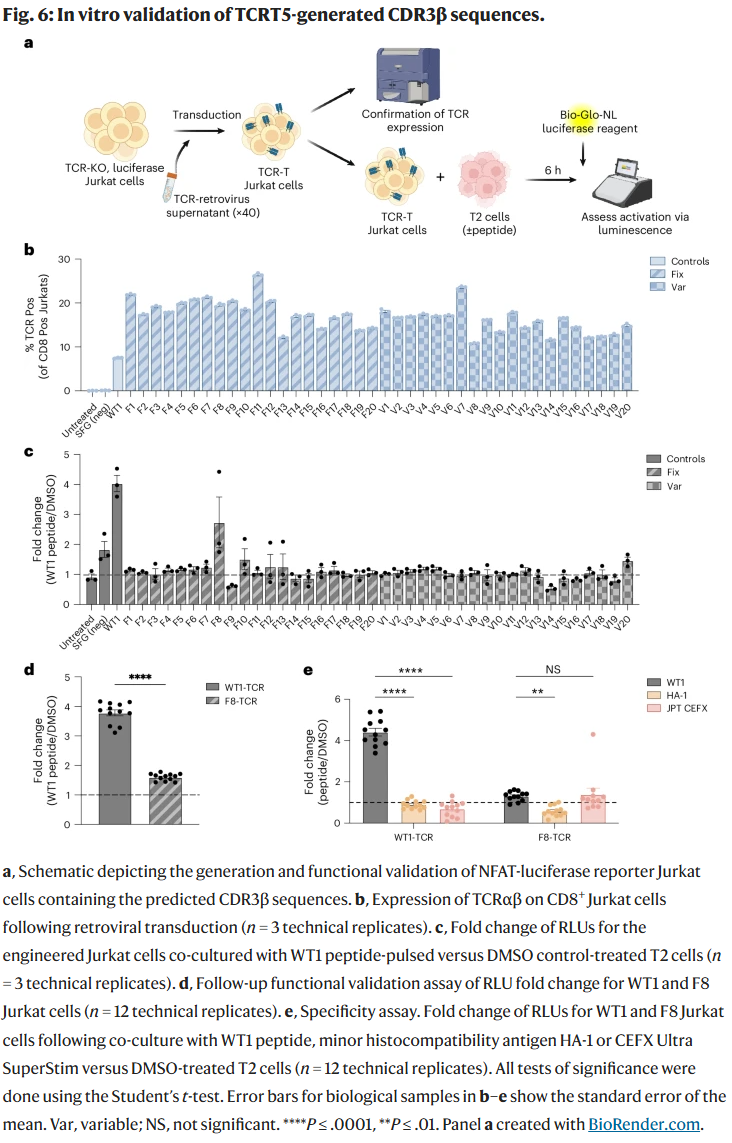
实验验证
研究人员在白血病相关的 WT1 抗原 上进行了体外实验。40 条生成的 TCR 构建体中,有 1 条(F8 序列)成功触发了 T 细胞的功能性激活。虽然命中率不高(1/40),但仍远超传统发现方法的效率。此外,所有 40 个构建体都能在细胞表面正确表达,验证了 CDR3β 序列嫁接的可行性。值得注意的是,F8 对 WT1 产生反应的同时,也对广谱病原体肽池有反应,提示特异性仍需提升。
讨论
本研究提出的 TCR-TRANSLATE 框架 展示了在稀疏数据条件下利用 seq2seq 模型快速生成抗原特异性 TCR 的可能性。旗舰模型 TCRT5 在计算基准与实验中均表现出色,首次实现了针对未见抗原的功能性 TCR 设计,代表着计算免疫学的一大进步。
然而,研究也暴露了若干挑战:
- 多特异性问题:模型倾向于生成多特异性 TCR,这虽符合生物学现实,但不一定满足临床对特异性的高要求。
- 数据稀缺与偏倚:当前数据集规模有限,尤其在非病毒抗原方面不足,制约了模型的广泛应用。
- 实验覆盖不足:现阶段实验验证仅集中于单一非病毒抗原,还需扩展到更多表位和不同免疫背景。
未来方向包括:
- 扩充和均衡高质量数据集;
- 引入结构信息和多模态特征提升建模能力;
- 开发更高效的训练与采样策略;
- 在临床相关抗原上进行更广泛的实验验证。
总体而言,这一研究为 个性化免疫治疗 提供了新的思路。通过计算机快速生成候选 TCR,能够极大缩小搜索空间,加速针对新发疾病或个体化需求的免疫疗法开发。
整理 | DrugOne团队
参考资料
Karthikeyan, D., Bennett, S.N., Reynolds, A.G. et al. Conditional generation of real antigen-specific T cell receptor sequences. Nat Mach Intell (2025).
https://doi.org/10.1038/s42256-025-01096-6
内容为【DrugOne】公众号原创|转载请注明来源
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2025-09-10,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

