结直肠癌转移的表型异质性和可塑性

文献概述
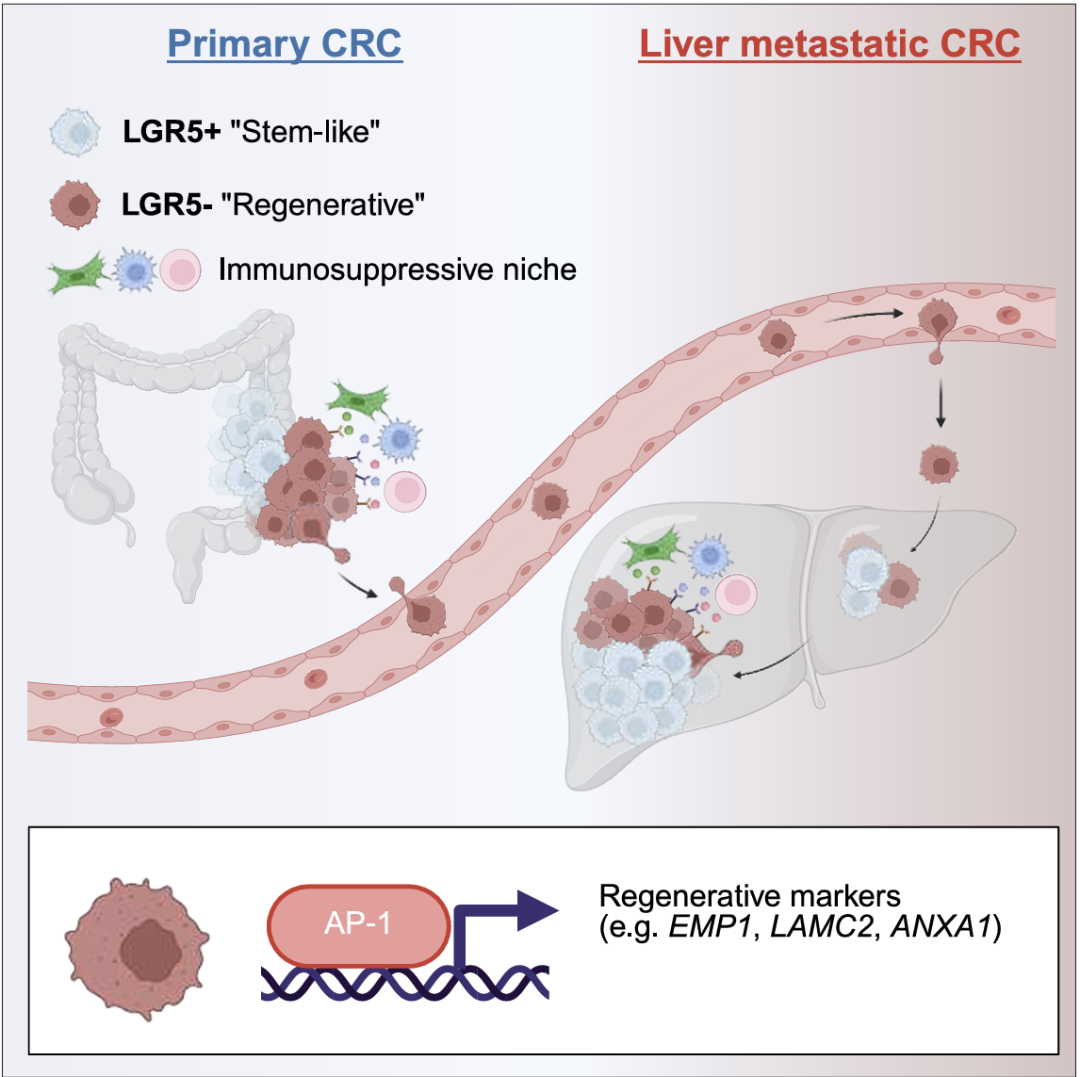
背景:结直肠癌(CRC)的表型异质性和可塑性(细胞响应外部信号进行快速表型转换并适应新微环境的能力)在肿瘤进展、转移和治疗耐药性中起着至关重要的作用。然而,驱动表型异质性的调节因素和外源信号仍然未知。表型可塑性在CRC进展和治疗耐药性中起关键作用。
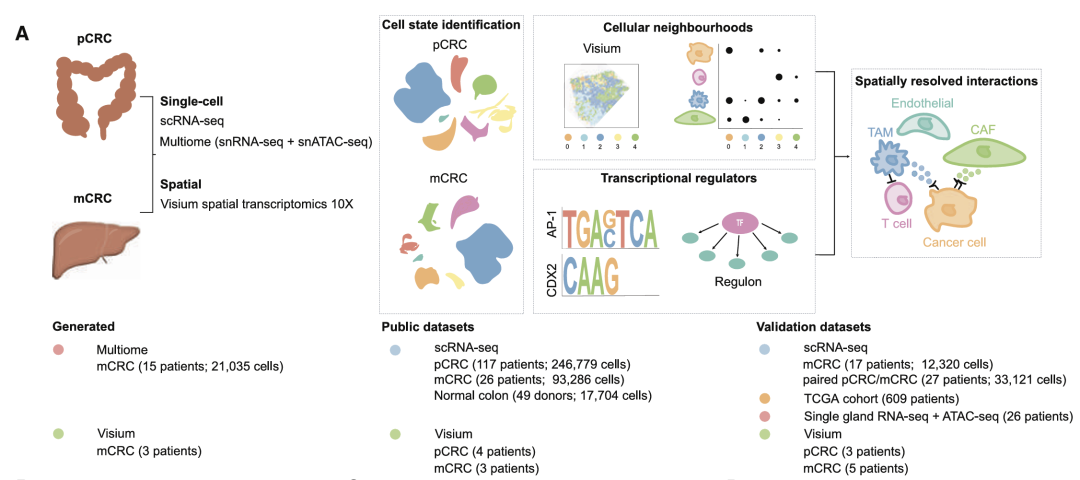
方法:结合来自原发性和转移性CRC患者的单细胞多组学和空间转录组学数据,揭示了具有再生和炎症表型的癌细胞状态,这些表型与小鼠模型中的转移起始细胞非常相似。
结果及结论:确定了一个具有混合再生和干性表型的中间群体。揭示了转录因子AP-1和核因子κB(NF-κB)是它们的关键调节因子,并显示了这些状态在原发性CRC和肝转移的侵袭边缘的免疫抑制生态位中的定位。揭示了配体-受体相互作用,预计会激活癌细胞中的再生和炎症表型。总之揭示了介导不同癌细胞状态的调节和信号转导因子,可以作为损害转移的潜在靶点。
文献内容
1.原发性CRC中的再生性炎症癌细胞状态
为了检查pCRC中恶性细胞状态和肿瘤微环境的细胞异质性,并了解这种情况在肝转移(LM)中的变化,整合了已发表的pCRC scRNA-seq,整合了117名未经治疗的CRC患者的数据,经过质控后,保留了来自246,779个细胞的转录组,包括癌症细胞、免疫细胞和基质细胞。
恶性细胞细分亚群表明,很大一部分表型异质性是由于癌细胞中的稳态干细胞和分化程序而产生的,观察到干细胞、TA、吸收性结肠细胞和分泌细胞。除了正常状态外还识别了癌症特异性细胞状态。两种状态与损伤/再生以及pCRC中描述的revSCS共享表达谱,以下简称再生细胞(REC)。基因富集分析显示REC中预后基因特征富集。一部分REC上调干扰素刺激基因(ISG),提示持续的炎症反应(以下简称炎症REC [iREC])。在癌症特异性状态中确定了健康结肠中不存在的干性状态,其特征是WNT拮抗剂上调,包括NOTUM、NKD1和APCDD1。还有iREC和stem样状态之间的混合过渡状态,上调趋化因子如CXCL2和CXCL3。
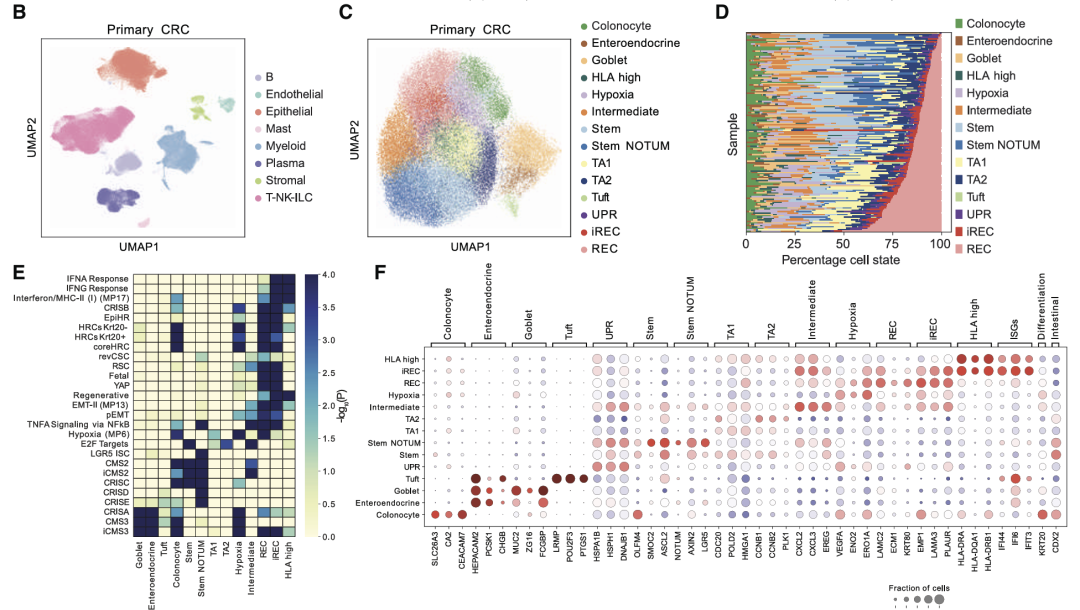
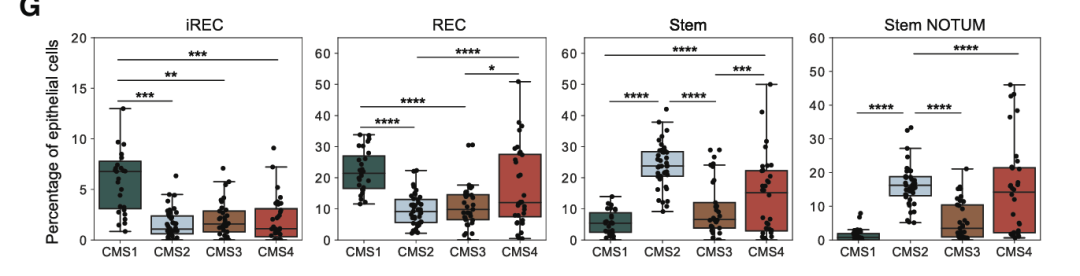
使用共有分子亚型(CMS)对肿瘤进行分类,stem和stem NOTUM状态在CMS2肿瘤中更为丰富。REC富集在富含免疫的CMS1和富含基质的CMS4肿瘤中,而iREC富集在CMS1肿瘤中,进一步表明由于与免疫系统的相互作用而上调炎症特征。
2.原发性CRC中LM模拟细胞状态的癌细胞状态
接下来研究LM的表型异质性与原发性CRC有何不同。质控后保留了21,354个细胞,包括恶性细胞、T细胞、髓系细胞、基质细胞和内皮细胞以及肝脏特异性肝细胞和胆管细胞。
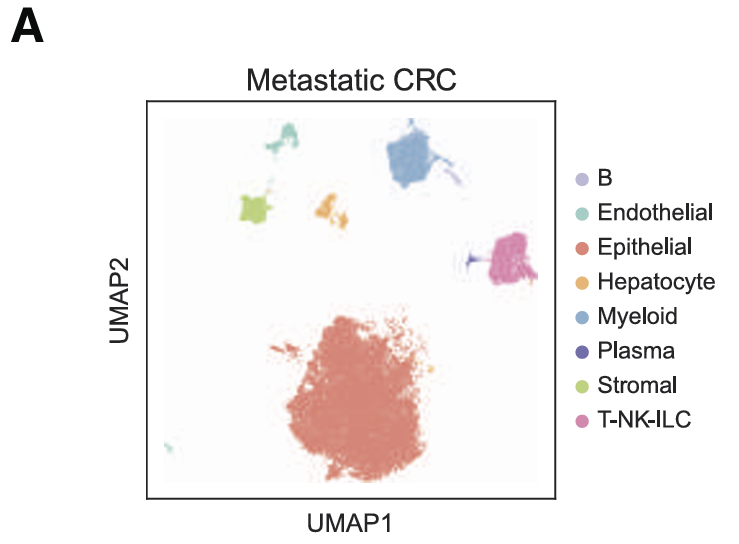
分离并分析了恶性细胞的转录组,与pCRC相似,表明在播散到肝脏后,转移起始细胞可以在远处重建原发肿瘤结构。与pCRC类似,预后不良的相关EpiHR和CRISB特征在iREC和REC中都富集,而INF-α/γ特征和ISG在iREC中上调。在pCRC和转移性CRC(mCRC)中,ISG富集于iRECs,而缺氧富集于RECs。
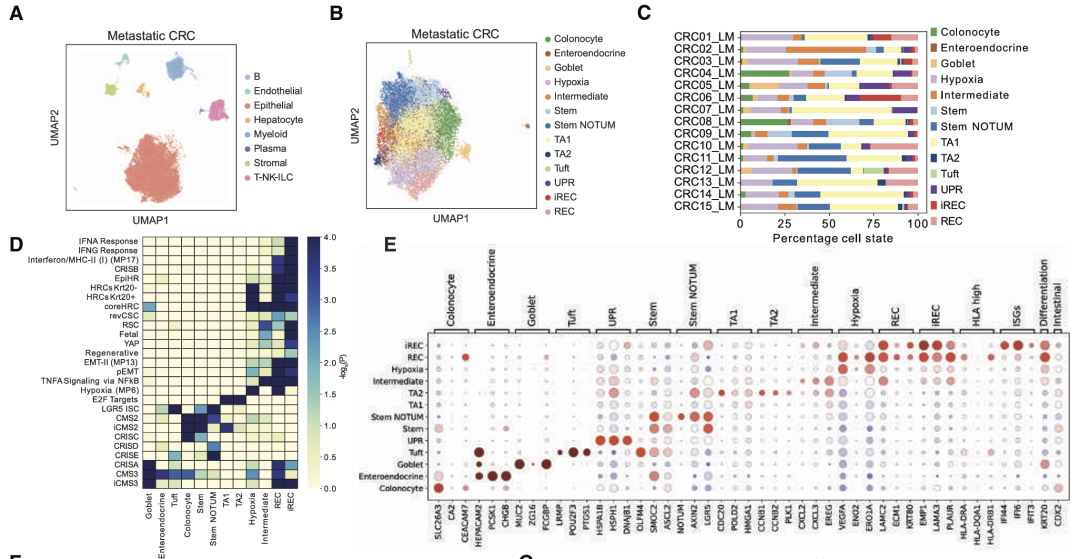
癌细胞状态特征存在于原发性和肝转移样本中。
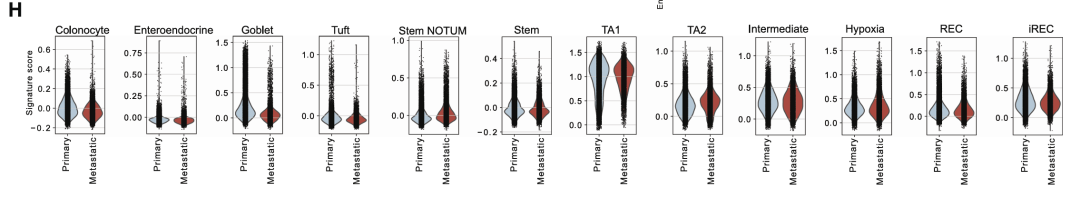
3.调节恶性状态的转录因子
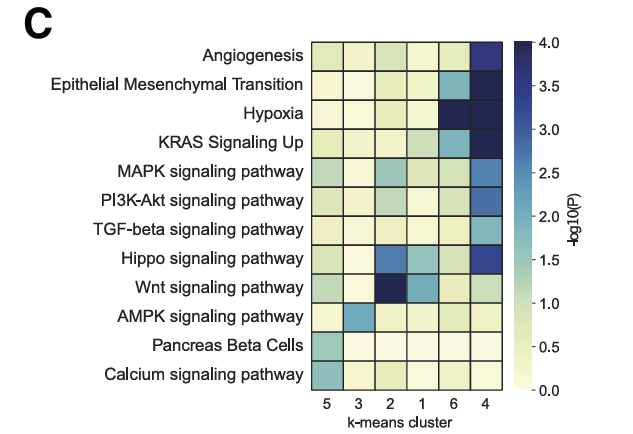
为了预测癌细胞状态的转录调节因子,接下来研究了mCRC数据集中可访问的染色质景观。为了识别假定的增强子,将基因的表达水平与远端染色质区域的可及性相关联,并鉴定了1,444个假定的增强子-基因连锁(PE-GL)。PE-GL的k-means聚类识别出与不同癌症状态相关的聚类,表明表观遗传调控。鉴定出细胞类型特异性PE-GL可能驱动干细胞(LGR5和ASCL2)、结肠细胞(SLC26A3)、iREC(EMP1、PLAUR和LAMC2)和缺氧(VEGFA)标记基因的表达。
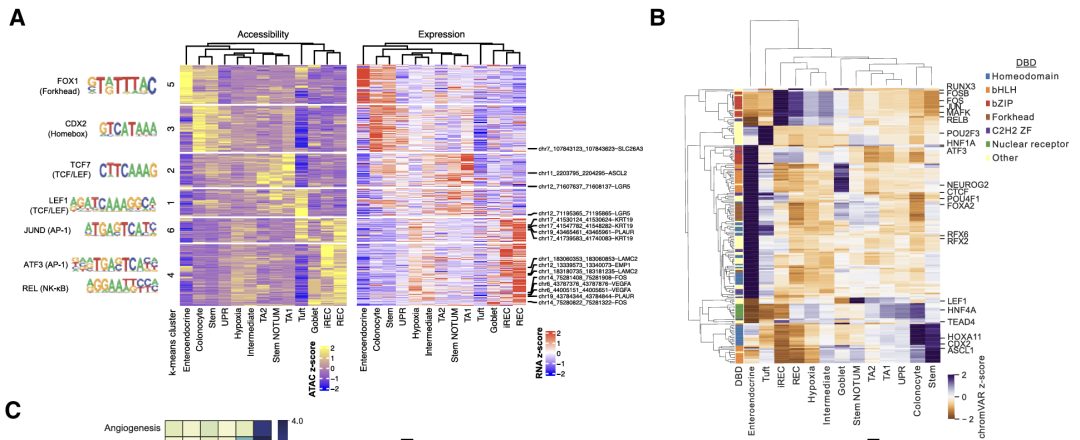
iREC状态(簇 4 和 6)中PE-GL簇中基因的GEA显示出缺氧、EMT、丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶和肿瘤坏死因子α(TNF-α)信号传导的富集,而WNT信号传导富集于干细胞NOTUM(簇1和2)细胞,支持转录组学数据。
评估了癌症状态下AP-1、NF-κB、ASCL2和LEF1调节子中基因的表达水平。与LEF1和ASCL2靶基因相比,AP-1和NF-κB靶基因在iRECs中表达最高,LEF1和ASCL2靶基因分别在簇状和茎NOTUM以及TA2和干细胞中表达最高。实验确定的AP-1靶基因在pCRC和mCRC的iREC中也以更高的水平表达。
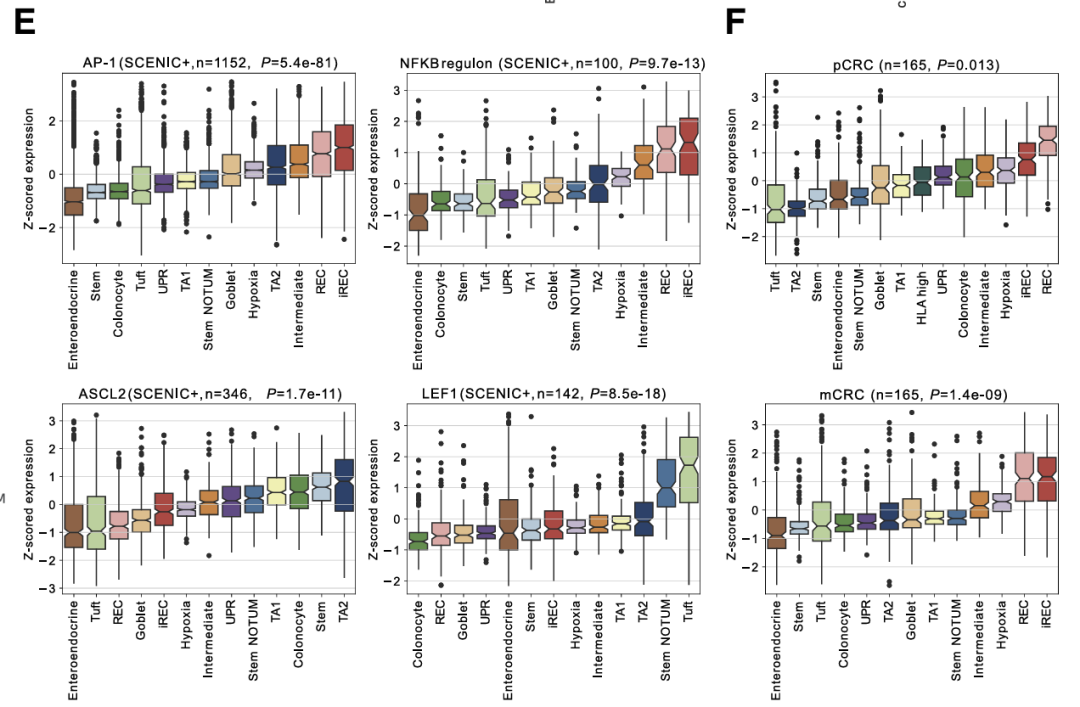
AP-1基序在 REC 中差异开放的染色质区域显着富集腺体和AP-1靶基因的更高表达。对TF调节子内基因的GEA显示,LGR5 ISC特征在ASCL2和LEF1调节子中显著富集,而许多富含在iRECs中的基因特征在AP-1家族成员中也显著富集,包括与预后不良(CRISB和EpiHR)和转移起始细胞(HRC)相关的特征。
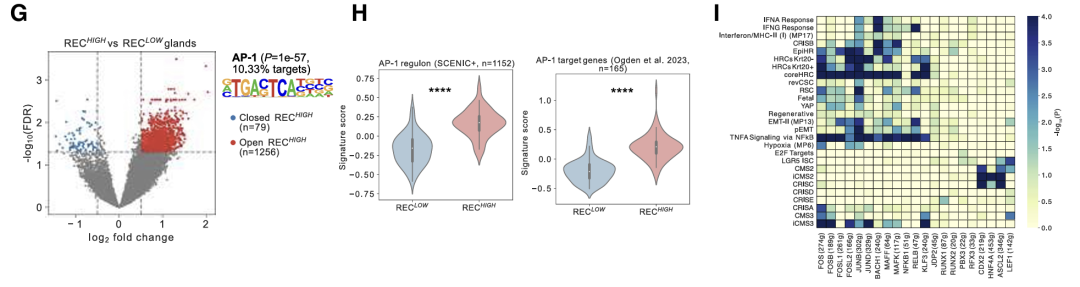
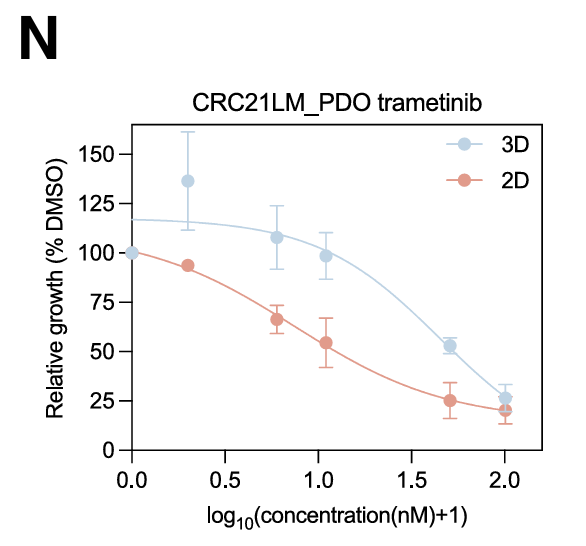
AP-1的抑制导致几个(i)REC标记物和预测的AP-1靶基因的显著减少。此外,AP-1抑制损害了类器官细胞在2D培养物中生长的能力。
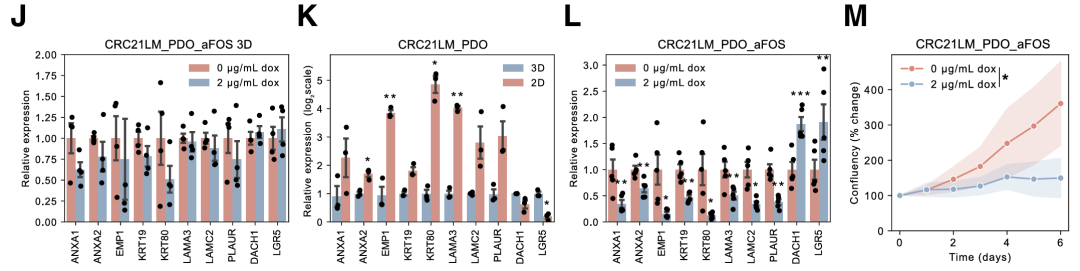
使用FDA批准的抑制剂曲美替尼,2D类器官显示出对MEK抑制的敏感性增加,表明特定的癌症状态具有特定的治疗脆弱性。总的来说,这表明MAPK信号传导与iREC 状态相关。
4.REC位于浸润性肿瘤边缘
为了剖析CRC肿瘤的空间组织,分析了来自4个pCRC样本的已发表的空间Visium数据。肿瘤核心和浸润边缘之间差异表达基因(DEG)的GEA显示,虽然细胞周期和WNT信号通路在肿瘤核心的上调基因中富集,但浸润边缘富含EMT,缺氧,IFN-γ反应,NF-κB,血管生成和Kirsten大鼠肉瘤病毒(KRAS)信号传导,进一步表明MAPK信号传导可能会在侵入性前沿驱动向iREC状态的转变。
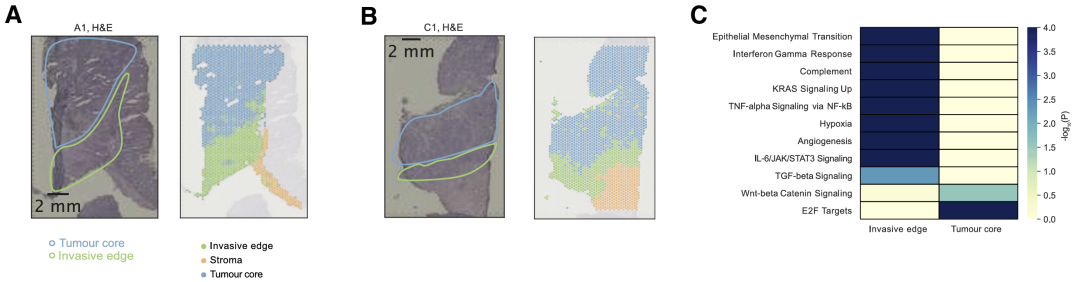
接下来使用cell2location将scRNA-seq数据定义的细粒度细胞类型/状态空间映射到它们的空间位置上。然后使用了 SpatialDE2以识别所有样品中的细胞生态位。研究结果揭示了iREC 在浸润性肿瘤边缘,进一步支持这些状态是假定的转移起始细胞的假设。
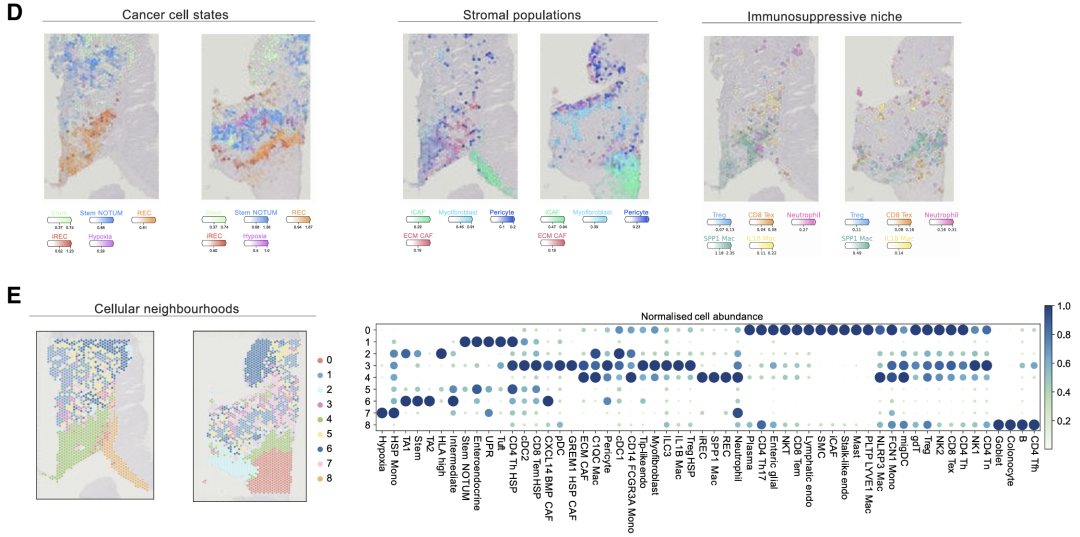
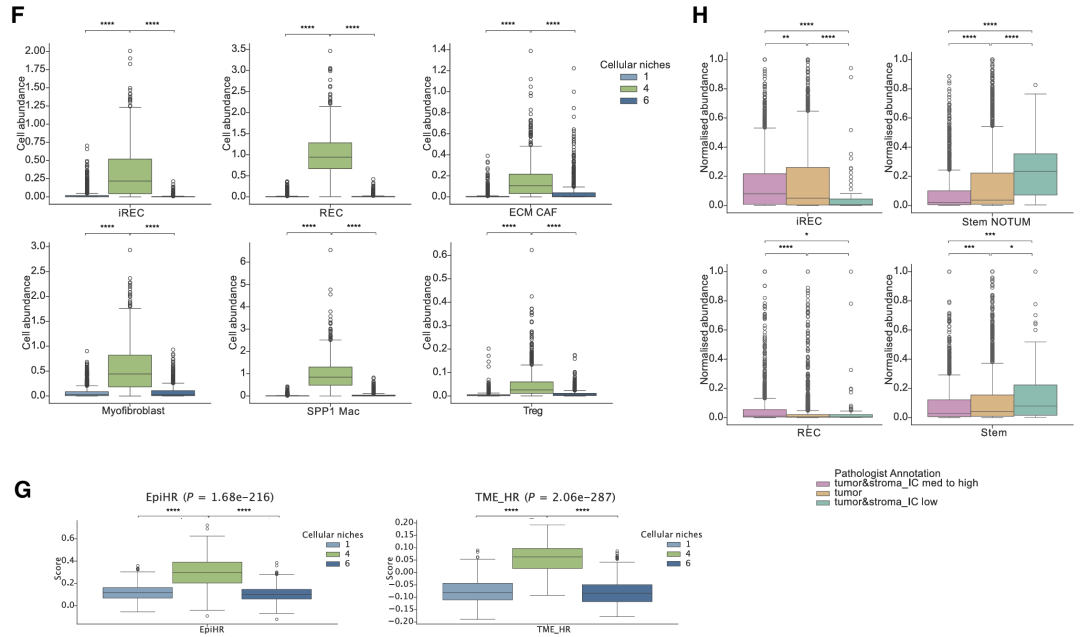
相比之下,肿瘤核心(邻域 1 和 6)的干细胞含量丰富。(一)侵袭边缘的REC与肌成纤维细胞和ECM CAF以及免疫抑制细胞(如SPP1巨噬细胞,中性粒细胞,耗竭的CD8T(Tex)细胞和Treg)共定位。与stem群相比,iREC在肿瘤-基质-免疫界面中显著富集,而stem群在肿瘤和肿瘤-基质低区域更丰富。
5.在 LM 的细胞生态位中组织癌症和 TME 细胞
与pCRC相比,LM中的癌症状态和TME如何相互作用。
LM 表现出不同的组织学生长模式,反映了癌细胞与周围肝实质相互作用的不同方式。结缔组织增生性生长模式(样品 LM4)的特征是由成纤维细胞和细胞外基质组成的结缔组织增生性胶囊,有效地包裹来自肝脏的转移性癌组织。相比之下,替代生长模式(样品 P13)中的癌细胞在肝细胞之间直接接触。iCAFs 在肝脏部位和肿瘤-肝脏界面富集,ECM CAF 在肿瘤-肝脏边界和肿瘤部位富含 C1QC 和炎性 IL1B 巨噬细胞,而肌成纤维细胞和免疫抑制性 SPP1 巨噬细胞浸润肿瘤核心。
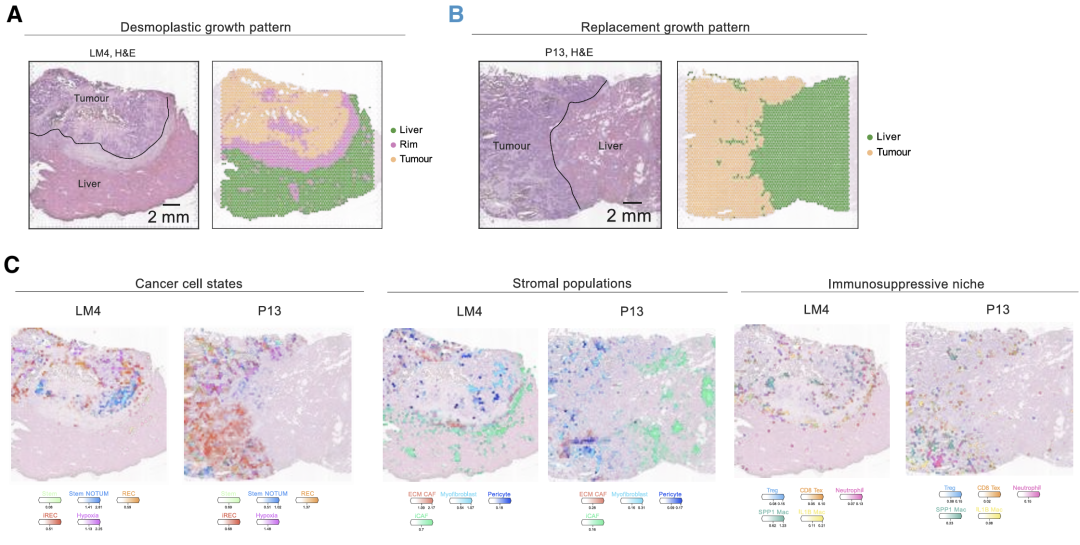
对所有六个 LM 样本的联合分析显示,空间隔离的癌症状态被组织成不同的局部邻域。iREC与pCRC中的侵袭边缘类似,与血管周围细胞,ECM重塑CAF和肌成纤维细胞聚集在免疫抑制生态位中,包括SPP1 TAM,IL1B / NLRP3 TAM,中性粒细胞,耗竭的CD8T细胞和Treg(邻域0和5,邻域3的低丰度)。干细胞驻留在自己的生态位中。
细胞邻域1和9表示肝实质,主要由肝细胞和库普弗细胞组成,它们分别对替换和结缔组织增生模式具有特异性。邻域3包括免疫调节CAF和免疫抑制细胞,主要富集在结缔组织增生边缘,而邻域2主要由免疫细胞组成,对样品CRC11和CRC09具有特异性。在iREC和免疫富集邻域(邻域 0、2、3 和 5)中上调的基因富集了EMT、IFN-γ 反应、KRAS信号传导和血管生成,而stem富集的生态位(邻域 4)富集了WNT信号通路。
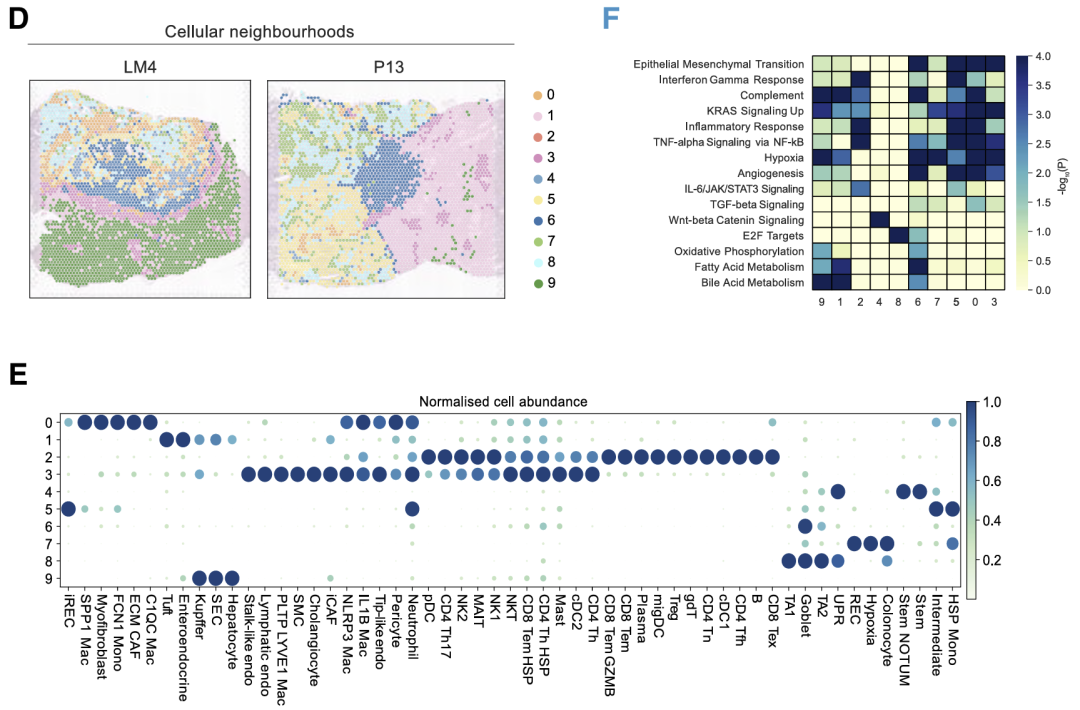
总体而言,CAF、巨噬细胞和耗竭的CD8T细胞的特定亚型介导原发性CRC和LM中iREC的表型。
6.癌症-TME 相互作用介导再生炎症细胞
使用了CellPhoneDB鉴定驻留在iREC周围空间生态位中的细胞状态中富集的受体-配体对。接下来,为了确定哪些配体可能促进癌细胞中的炎症再生程序,使用 NicheNET 确定了预测诱导AP-1和NF-κB调节子的配体。结果揭示了可能激活AP-1靶基因的CAF和髓系配体的候选列表,相应的受体在(i)REC中上调。
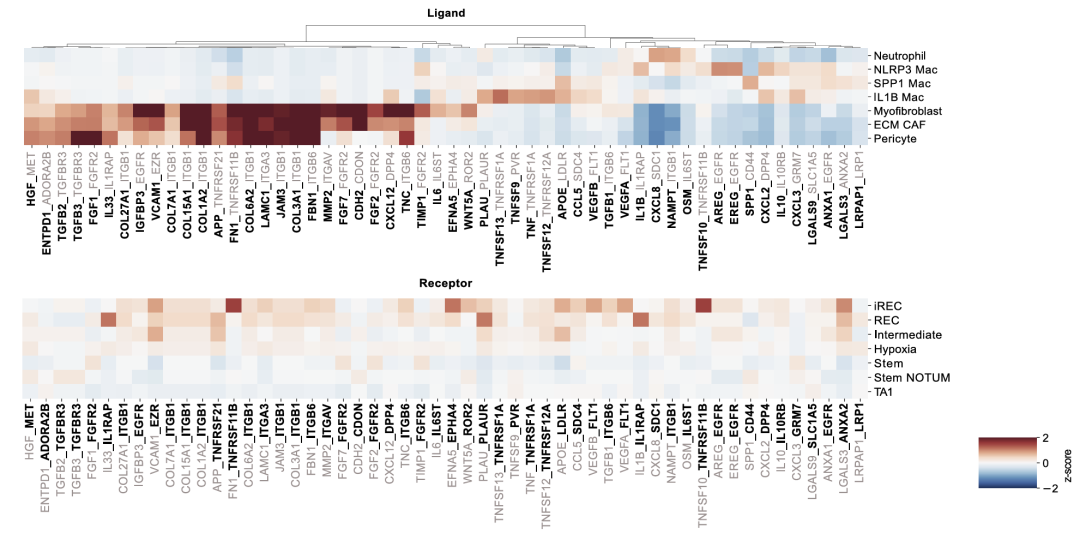
EMT、MAPK 信号传导、炎症反应和IFN-γ反应的富集,这些过程在iREC中被激活。IL1B巨噬细胞和耗竭的CD8T细胞来源配体的表达与(i)REC特征高度相关。
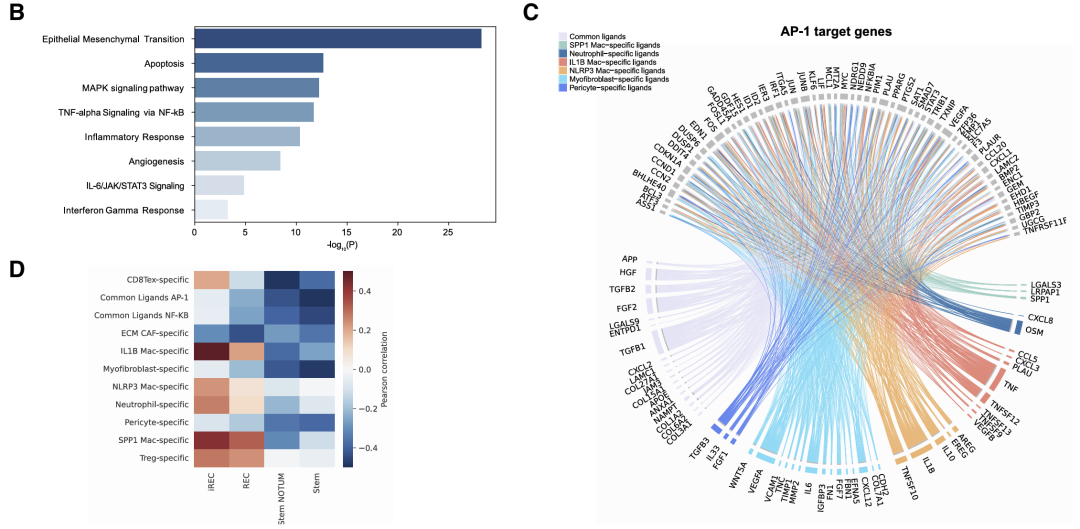
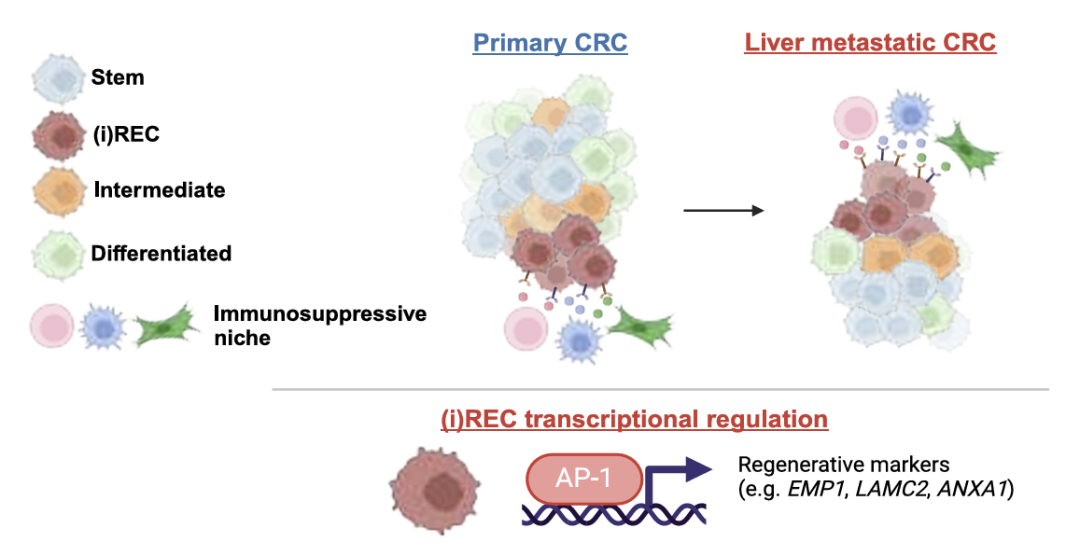
总的来说,这些结果突出了预计会在iREC中诱导再生和炎症表型的配体,并可能通过靶向维持iREC状态的细胞生态位中的特定分子机制来导致潜在的治疗策略。
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2025-07-20,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读
目录

