Annu. Rev. Phytopathol. (全文翻译)| 宿主植物对细菌生长和行为的调控
Annu. Rev. Phytopathol. (全文翻译)| 宿主植物对细菌生长和行为的调控
小汪Waud
发布于 2024-07-12 17:11:24
发布于 2024-07-12 17:11:24
2024年6月10日,华中农业大学Kenichi Tsuda团队于Annual Review of Phytopathology发表了题为Regulation of Bacterial Growth and Behavior by Host Plant的综述论文。 综述总结了植物如何利用物理屏障、控制共享资源如水和营养物质、以及产生抗菌分子来调控细菌的生长和行为。论文还强调植物利用专门的代谢物质来支持或抑制特定的细菌,从而选择性地招募与植物相关的细菌群落并调节其功能。在未来进一步解析植物选择促进植物健康的微生物群的确切机制将有助于通过部署定制微生物群或调节局部微生物群来实现可持续农业发展。

引言
在自然界中,植物不可避免地与多种微生物共存,包括细菌、真菌、卵菌和病毒。一些微生物是植物病原体,损害植物的生长和繁殖。植物通过预先形成的结构和分子屏障,以及在识别病原分子后诱导的防御机制来抵御病原体,这些防御机制通过细胞表面的PRRs和细胞内的NLRs实现。PRRs识别PAMPs或MAMPs以及宿主来源的DAMPs和植物细胞因子,从而激活PTI。NLRs直接或间接识别效应分子,从而激活ETI。虽然NLRs在大多数情况下只识别病原分子,但PRRs识别无论来源于病原体还是共生和有益微生物的分子。实际上,PRRs有助于维持健康的称为微生物组的植物相关微生物群落,并帮助防止引起植物疾病的微生物菌群失调(稳态失衡)。因此,植物免疫系统不仅可以对抗病原体,还可以调控共生和有益微生物。包括细菌、真菌和卵菌在内的微生物群落的重组实验表明,细菌定殖对植物在自然界中的生存是必不可少的。这不仅表明某些细菌是植物的朋友,而且它们集体上是植物在自然环境中生存的必要组成部分。因此,植物面临一个困境,即它们需要细菌定殖来生存,但同时也受到一些细菌的攻击。因此,植物需要选择性地招募细菌,但同时要防御病原体并控制共生和有益细菌的行为。植物如何实现这些目标呢?
1 细菌的物理调控
细菌进入植物组织以获取营养并在环境中繁衍。在这一过程中,细菌会遇到植物动态调节的物理防御机制。
1.1 气孔和水孔
在植物叶片表面,病原细菌通过气孔(stomata)侵入植物。气孔是由两个保卫细胞形成的小孔,负责控制气体交换和水分蒸发。为了限制病原体进入内层组织,植物部署了气孔免疫,在识别到MAMPs时关闭气孔,以防止病原体感染。近年来,研究人员鉴定了多种植物成分和气孔免疫机制。细菌病原体还通过位于叶缘的水孔(hydathodes)侵入叶片组织,水孔是通过吐水作用释放多余细胞外液的部位。水孔直接连接到叶片的木质部,这使得病原体可以系统性地感染植物。与气孔不同,病原体感染不会导致水孔关闭,但水孔可以诱导侵入后的水孔免疫,抑制适应性细菌病原体的繁殖,并限制不适应性病原体扩散到维管系统。尽管相关的植物免疫信号成分已被鉴定,但水孔免疫如何限制细菌扩散仍然未知。
1.2 侧根和根毛
在根际环境中,病原细菌可以通过新生的侧根进入植物组织。Pseudomonas syringae会通过AUXIN RESPONSE FACTOR7/ARF19-LATERAL ORGAN BOUNDARIES-DOMAIN依赖的方式诱导侧根的形成。由于在没有细菌感染的情况下,拟南芥侧根中对flg22有感知作用的FLS2活性相对较高,因此植物可能会特别保护侧根免受细菌感染。然而,植物是否以及如何限制病原细菌在根组织中的入侵仍然不清楚。固氮根瘤菌通过由宿主豆科植物根毛细胞形成的侵染线(infection threads)侵入根内。
1.3 角质层和细胞壁
植物角质层由角质素的高分子框架和统称为蜡质的多种有机脂类组成,覆盖在组织表面。植物角质层作为抵御病原体的前线物理屏障,在病原体感染期间会被重塑。几项研究表明,蜡质和角质素的组成影响非病原细菌群落的多样性和丰度;然而,对于角质层如何影响细菌定殖的研究知之甚少。在角质层之后,细菌会遇到由多糖(包括纤维素、半纤维素和果胶)组成的植物细胞壁。许多病原细菌分泌细胞壁降解酶以松解或降解植物细胞壁以获得空间或营养,但细胞壁降解产物可被宿主植物识别为DAMPs以激活PTI。植物在病原体感染期间会修饰和重新合成细胞壁成分,如胼胝质(callose)、木质素(lignin)和栓质(suberin)。胼胝质在病原体感染时合成,似乎具有强化细胞壁的功能,抑制病原体扩散。胼胝质可以响应细菌感染限制胞间连丝孔径,从而抑制促进病原体毒力的细菌效应蛋白的细胞间移动。木质素和栓质也具有强化细胞壁的功能。木质素和栓质的沉积受到动态调节,并定位于感染部位以抑制细菌病原体扩散。由于基因突变导致胼胝质或木质素积累减少会引起防御植物激素水杨酸(SA)水平升高,植物可能监测细胞壁的完整性,当物理防御受损时激活防御信号。植物在木质部也有结构屏障,木质部细菌病原体在那里定殖。相邻的薄壁细胞形成伴随凝胶的栓塞,作为木质部的结构屏障,从而限制病原体的扩散。
1.4 细胞死亡
细菌病原体可以触发一种称为超敏反应(HR)的免疫反应,这是一种植物特有的程序性细胞死亡。拟南芥I型类半胱氨酸蛋白酶AtMC1是ETI诱导的HR正调节因子。然而,缺乏AtMC1并不影响P. syringae的生长,表明HR期间的细胞死亡不会导致P. syringae的生长抑制。与此一致,ETI并不抑制HR发生的感染部位的P. syringae生长,而是抑制远端部位的P. syringae。因此,HR似乎抑制细菌扩散而不是繁殖。
2 利用共享资源的变化实现对细菌的调节
细菌利用植物环境中的营养物质和水分来促进毒力和生长。相应地,植物通过改变这些营养物质和水分水平来控制细菌的生长。
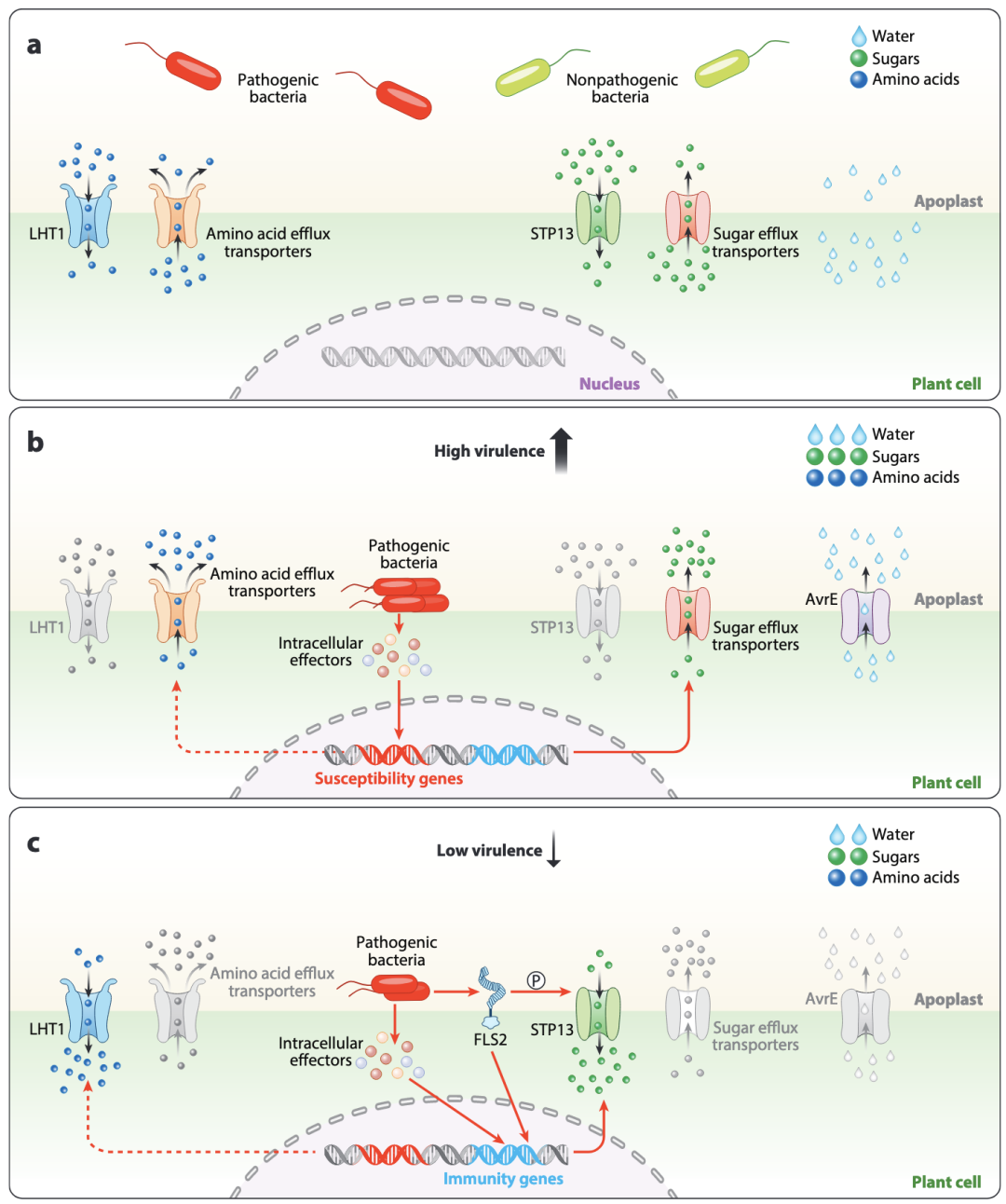
图1. 通过共享资源调控细菌行为。(a) 植物向胞间隙分泌/释放共享资源(例如,糖类、氨基酸和水),从而帮助病原性和非病原性细菌的定植。(b) 病原体通过激活宿主的糖类和氨基酸外流转运蛋白以及将效应子AvrE作为水透性通道导入宿主跨膜,以增加胞间隙中共享资源的量,进而发挥其毒力。(c) 当病原体发挥其毒力时,宿主植物通过模式触发免疫(PTI)和/或效应因子触发免疫(ETI)诱导其免疫反应,进而激活诸如STP13和LHT1等内流转运蛋白,以减少胞间隙中的共享资源量。这导致病原体的毒力和生长受到抑制。实线表示已建立的连接。虚线表示假设/潜在的关联。灰色的转运蛋白表示未激活。箭头和线条的粗细代表支持或抑制的不同强度。
2.1 糖类和酚类化合物
细菌使用植物来源的分子如糖类作为碳源。自由生活的细菌能够感知并向这些分子移动,这种运动称为趋化性。例如,半乳糖、葡萄糖及其他几种糖类是革兰氏阴性细菌病原体根癌农杆菌(Agrobacterium tumefaciens)的趋化性物质,根癌农杆菌可引起多种植物的冠瘿病。根癌农杆菌中的一个周质糖结合蛋白直接与糖结合,并且是趋化性和毒力基因的诱导所必须的。其他病原体如引起软腐病的Dickeya dadantii也表现出对糖类的趋化性,但其机制大多尚不清楚。为什么植物会分泌这些吸引敌人的分子?一个答案是植物分泌这些分子是为了吸引促进植物生长和健康的细菌。实际上,有益细菌如Bacillus subtilis OI1085、Bacillus amyloliquefaciens SQR9、Bacillus megaterium YC4和Ensifer meliloti(以前称为Rhizobium meliloti和Sinorhizobium meliloti,以固氮细菌而闻名)也表现出对植物来源的糖类或糖醇的趋化性。甲基受体趋化性蛋白(MCPs)缺失的SQR9突变体对糖类没有趋化性,表明这些MCPs作为糖类的趋化性受体发挥作用。这些结果表明,植物分泌光合作用同化的分子如糖类,以招募有益细菌,但代价是也吸引了病原细菌。
病原细菌在感知宿主来源的代谢物后,需要正确激活其毒力程序。由宿主来源分子激活细菌毒力的最佳例子是根癌农杆菌。植物来源的酚类化合物如乙酰丁香酮和糖类激活根癌农杆菌毒力。VirA是一个膜定位的感应激酶,与细胞质反应调节因子VirG组成双组分调控系统,负责通过可能与乙酰丁香酮结合来激活毒力。此外,糖-ChvE(一个周质糖结合蛋白)复合物与VirA的周质结构域似乎促进毒力。植物来源的诱导毒力代谢物的数量和类型可以决定根癌农杆菌的宿主范围。例如,糖酸是对伽蓝菜(Kalanchoe daigremontiana)叶片中毒力诱导的重要成分,而中性糖在烟草叶片中至关重要。因此,植物可以通过改变糖类种类和水平来调节根癌农杆菌的毒力。
宿主来源的糖类对于其他病原细菌的毒力激活也是必需的。在P. syringae中,含糖的培养基足以激活III型分泌系统(T3SS),这是一种宿主细胞中的蛋白分泌机制,是病原性的重要组成部分。此外,多种与糖类摄取和代谢相关的基因也与毒力基因表达相关。另外,P. syringae通过诱导糖外排转运蛋白来增加毒力,这与细菌病原体Xanthomonas oryza在水稻中所做的类似。因此,植物来源的糖类既是P. syringae 的营养物质,也是毒力激活因子。值得注意的是,在P. syringae感染期间,植物通过糖转运蛋白STP13 将糖从P. syringae 定殖的叶片质外体中隔离出来。通过STP激活吸收感染叶片中的细胞间隙糖类,增加细胞内葡萄糖-6-磷酸水平,促进植物免疫反应。因此,这种糖隔离可能通过减少营养物质、降低毒力并激活植物免疫反应来限制P. syringae 的生长。
软腐病细菌病原体肠杆菌科Enterobacteriaceae(Dickeya和Pectobacterium属)的毒力由植物来源的糖类激活。这些病原体的关键毒力基因编码果胶降解酶。Dickeya dadantii的果胶降解酶将果胶分解为低聚半乳糖醛酸,这些低聚半乳糖醛酸被用作碳源。其中一种果胶分解产物2-酮-3-脱氧葡糖酸进一步诱导果胶降解酶的表达。虽然需要进一步研究,但植物细胞壁的强化可能干扰果胶降解,从而降低肠杆菌科病原体的毒力。此外,植物将低聚半乳糖醛酸作为DAMPs来感知并激活PTI,这有助于抑制细菌的毒力。
许多革兰氏阴性细菌病原体如引起十字花科植物黑腐病的Xanthomonas campestris,利用群体感应进行细菌细胞间的通讯以促进毒力。群体感应通常由细菌分子N-酰基高丝氨酸内酯(AHLs)介导。植物来源的酚类化合物通过降低某些病原菌中的AHL水平来抑制群体感应。植物还分泌AHL模拟物干扰群体感应,但大多数AHL模拟物的实际分子尚未被识别。最近的一项研究表明,X. campestris通过AHL感应器感知植物来源的葡萄糖以刺激毒力。有趣的是,虽然植物如何感知AHLs仍不清楚,但一些AHLs能够激活植物免疫反应并增加对病原体的抵抗力。
2.2 氨基酸和有机酸
细菌将氨基酸和有机酸作为碳源和氮源。氨基酸和有机酸也是植物分泌到叶片和根部质外体中的主要成分,占已鉴定植物相关细菌趋化性物质的约80%。例如,Ralstonia solanacearum和Ralstonia pseudosolanacearum被各种氨基酸和有机酸吸引。Ralstonia solanacearum的组氨酸激酶CheA和CheW缺失突变体表现出无趋化性。Ralstonia pseudosolanacearum的McpM和McpA分别为对L-苹果酸和氨基酸的趋化性所必须的。在植物有益细菌中也鉴定出了对氨基酸和有机酸的MCP趋化性受体,如荧光假单胞菌(Pseudomonas fluorescens)、恶臭假单胞菌(Pseudomonas putida)、解淀粉芽孢杆菌(B. amyloliquefaciens)、枯草芽孢杆菌(B. subtilis)和蒺藜苜蓿固氮菌(Ensifer meliloti)。因此,与糖类相似,植物分泌氨基酸和有机酸以吸引有益细菌,同时不可避免地也会吸引病原体。
宿主来源的氨基酸和有机酸也被细菌病原体用作诱导毒力的信号。例如,在P. syringae中,天冬氨酸和谷氨酸能够诱导T3SS基因的主调控基因 hrpRS 和 hrpL 的表达。考虑到天冬氨酸和谷氨酸是植物中最丰富的氨基酸,氨基酸对T3SS表达的调节可能是P. syringae 毒力进化的早期步骤。事实上,P. syringae会触发氨基酸外排转运蛋白的表达以增强毒力。为了对抗细菌病原体,植物改变叶片质外体中氨基酸的含量。拟南芥质外体洗脱液的代谢组学分析显示,在PTI期间叶片质外体中的脯氨酸和丝氨酸含量下降。在植物中的生理浓度下,这两种氨基酸可诱导hrpL的表达。脯氨酸对hrpL的诱导依赖于PutA,这是一种将脯氨酸分解为谷氨酸的细菌酶。通过PTI从叶片质外体中去除脯氨酸需要植物氨基酸转运蛋白LHT1。由于脯氨酸也可能是P. syringae的营养物质,脯氨酸的缺乏可能通过营养缺乏和毒力下降来饿死细菌。植物来源的有机酸也有助于P. syringae T3SS基因的表达。有趣的是,在一种具有持续免疫活性的拟南芥突变体中,有机酸水平下降,导致T3SS表达减少。这表明,作为免疫反应,植物积极地通过质外体隔离有机酸。
γ-氨基丁酸(GABA)是一种非蛋白质氨基酸,是许多植物叶片质外体中最丰富的代谢物之一。P. syringae DC3000的趋化受体PscC直接与GABA和脯氨酸结合,这是在喷雾感染过程中是产生毒力所必需的。P. syringae 6605通过McpG感知并被GABA吸引,McpG在根部浸染实验中对毒力是必需的。因此,GABA感知有助于P. syringae 的运动性。虽然GABA作为P. syringae 的趋化性物质,但它也抑制T3SS基因的表达和毒力。与此一致,一种积累较多GABA的拟南芥突变体对P. syringae 更具抗性。一种缺乏GABA代谢所需的假定转氨酶的P. syringae 突变体对GABA高度敏感,并显示出增强的hrpL抑制和在拟南芥叶片中的毒力降低。GABA还通过操纵细菌群体感应信号抑制根癌农杆菌A. tumefaciens在烟草叶片中的生长,这表明植物来源的GABA以不同方式抑制不同细菌的毒力。与此相反,茄科雷尔氏菌Ralstonia solanacearum具有III型效应蛋白RipI,能够增强GABA的产生以支持细菌的营养。此外,尽管GABA抑制丁香假单胞菌的毒力基因表达,丁香假单胞菌仍具有GABA渗透酶能够吸收GABA,并且GABA代谢基因在叶片定殖时被诱导。因此,细菌病原体已经进化出应对植物来源GABA的机制。
2.3 水和矿物营养
病原细菌的成功感染需要特定的环境条件,例如可用的水和矿物质。宿主、病原体和环境之间的相互作用已经被认识超过50年,称为“病害三角”。特别是由于降雨导致的大气湿度高促进了病原细菌在叶片表面的移动、侵入和繁殖,从而在叶片质外体引发一种称为水渍(water-soaking)的症状。人工制造的水渍允许病原细菌的猛烈繁殖,这表明质外体中的水环境有利于细菌的生长。实际上,体内成像显示P. syringae 在叶片浸水区域的生长得到促进。P. syringae 的T3SS效应蛋白促进植物激素脱落酸(ABA)的积累和信号传导,从而引发气孔关闭和水渍。值得注意的是,P. syringae 的T3SS效应蛋白AvrE是一种水通道蛋白。因此,它可能通过自身插入植物质膜的通道直接增加水的可用性。为了对抗这种细菌毒力策略,植物分泌的肽SCREW及其对应的受体NUT抑制ABA介导的气孔关闭,从而破坏细菌生长的重要水环境。最近的一项研究表明,在持续光照下,SA抵消了ABA介导的气孔关闭,从而促进气孔开启并抑制P. syringae 的生长。
矿物营养如钙和铁也作为细菌毒力促进信号发挥作用。作为真核生物,细菌严格控制胞质中的钙浓度,使其远低于细胞外空间的浓度,从而利用钙作为环境信号。例如,尽管缺乏体内证据,但P. syringae 似乎通过识别植物钙离子来激活T3SS基因表达。铁稳态在植物病原细菌中受到复杂调控网络的严格控制,因为铁缺乏或过量对细菌有毒。细菌分泌铁载体以螯合质外体中的铁,从而促进铁的摄取,进而增强毒力。P. syringae 的T3SS效应蛋白AvrRps4通过使拟南芥的铁传感蛋白BRUTUS失活来增加质外体铁,从而促进铁的摄取和细菌的生长。除了病原细菌外,有益细菌也调节质外体中的铁稳态。植物有益细菌地衣芽孢杆菌Bacillus velezensis通过VII型分泌系统的效应蛋白YukE插入植物质膜,导致根部铁泄漏,促进生物膜形成和根部定殖。生物膜形成是细菌细胞聚集形成集体并嵌入自身产生的基质中的过程,对细菌定殖和病原细菌的毒力往往很重要。因此,细菌使用各种策略确保铁的摄取。相反,拟南芥分泌防御素蛋白PDF1,螯合铁并激活铁缺乏介导的免疫,以对抗引起细菌软腐病的革兰氏阴性细菌病原体Pectobacterium carotovorum。PTI和ETI都抑制了P. syringae 的细菌铁摄取途径的表达,仿佛处于铁丰富的条件下,但不影响质外体铁浓度,这表明植物免疫通过向细菌发送错误信号干扰P. syringae的铁途径。虽然动物免疫使用过量的铁作为免疫机制来抑制病原体,但植物是否也采用这种方法来抑制细菌病原体尚不清楚。
3 植物防御分子对细菌的调控
植物产生各种防御分子,以特异性地影响细菌的生长和行为(见表1)。
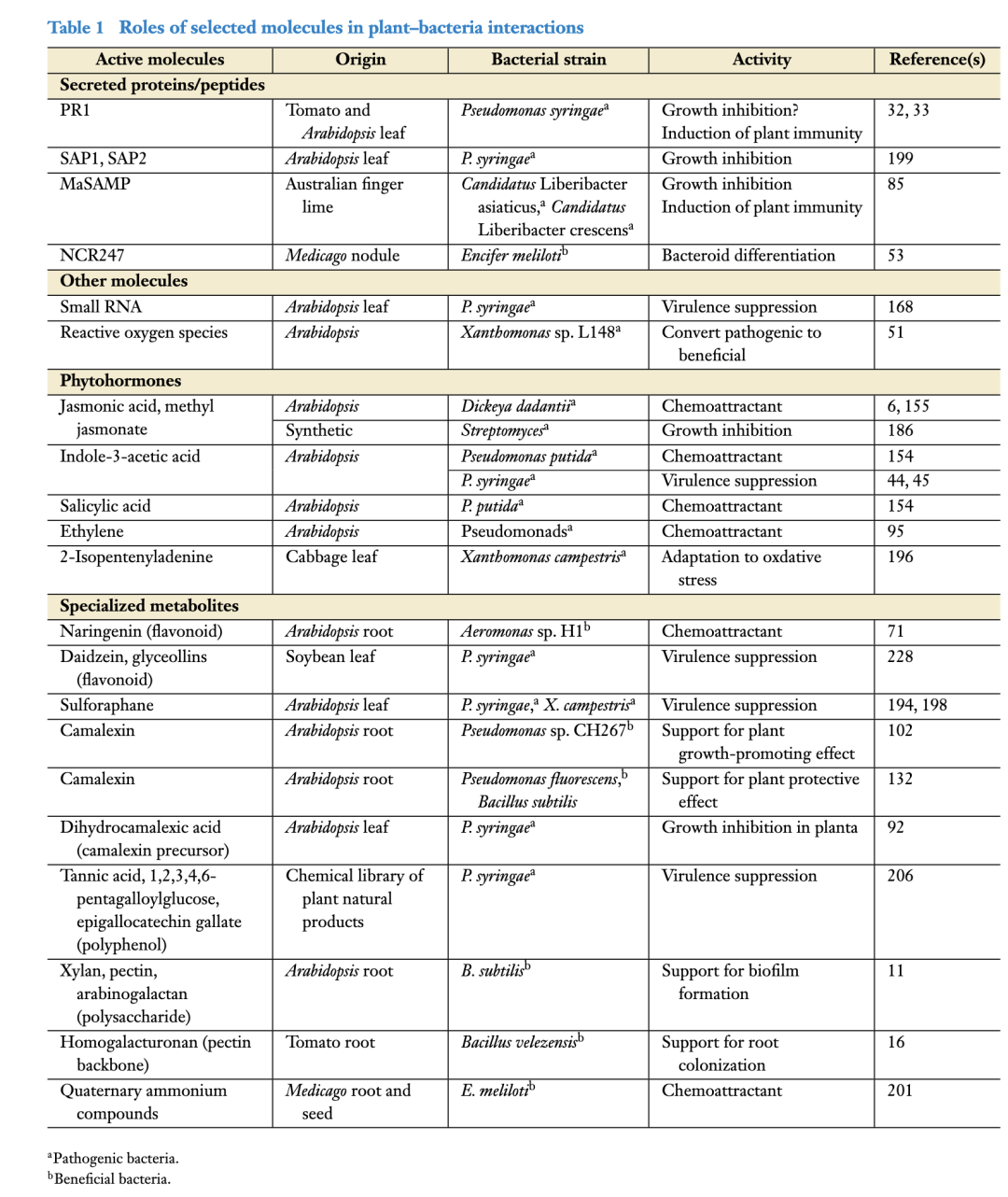
表1 不同分子在植物-细菌相互作用中的作用
3.1 分泌蛋白/肽
植物在免疫反应过程中分泌抗菌蛋白和肽。病程相关(PR)蛋白是病原体感染时植物分泌的蛋白质,已被分类为19组:PR-1到PR-19。尽管PR蛋白的研究历史悠久,但其在植物中的分子功能仍大多不清楚。研究表明,拟南芥和番茄的PR1在病原体感染和SA诱导的免疫反应中作为分子标志物,其C末端被切割,生成诱导免疫反应的11个氨基酸的肽。全长PR1也分泌到质外体中,并在体外可作为抗菌蛋白。因此,PR1具有两个不同的功能:作为信号分子诱导免疫反应和作为杀菌剂。其他一些PR蛋白在植物中过表达时也能赋予植物对细菌病原体的抗性,但PR介导免疫的分子基础尚不清楚,需要进一步研究。
其他分泌蛋白也直接抑制细菌生长。例如,拟南芥分泌的SAP1和SAP2分泌到叶片质外体中,切割P. syringae 的毒力蛋白MucD,该蛋白在细菌中进化上保守且是毒力所必须的,从而削弱细菌在植物中的定殖。SAP1过表达的植物表现出增强的MucD切割能力和对P. syringae 的抗性,而sap1 sap2双突变植物表现出削弱的MucD切割和抗性。携带不可切割版本MucD的P. syringae 对SAP1介导的免疫不敏感。这些结果强有力地证明了植物分泌的SAP蛋白在质外体中直接抑制细菌毒力。
抗菌肽(AMPs)是一类广泛存在于自然界中的小分泌肽或从分泌蛋白中切割出来的肽,对真菌、卵菌、细菌和病毒具有特异性的抑制作用。由于其作为人类药物的价值,许多研究调查了植物来源的分泌肽的抗菌活性。然而,大多数植物AMPs的生物活性是通过体外检测的,而不是在植物中。因此,尽管缺乏它们在植物-微生物相互作用中的生物学意义的证据,Huang等人通过比较敏感柑橘品种与抗性柑橘杂交种及其近缘种对抗最具破坏性的柑橘黄龙病(由革兰氏阴性细菌病原体亚洲黄龙菌引起)的差异,鉴定出抗性柑橘植物中的稳定的AMPs(SAMPs)。从指橙Microcitrus australasica(Ma)中分离出的SAMP对可培养的Liberibacter菌株Liberibacter crescens和其他α-变形菌具有热稳定的杀菌活性。重要的是,在温室试验中,喷洒外源MaSAMP抑制了CLas在感染树中的增殖和病害症状。MaSAMP处理还诱导植物免疫反应。因此,AMPs可以兼具杀菌剂和免疫诱导剂的双重功能,并可以作为控制农田中细菌病原体引起的疾病的有力工具。
在豆科植物与根瘤菌的共生中,宿主介导的类杆菌(固氮根瘤菌的内共生形式)的末端分化需要只在根瘤菌的共生细胞中表达的AMP样富含半胱氨酸(NCR)肽。药用苜蓿Medicago truncatula的NCR247是功能最为明确的肽,参与根瘤菌的分化。NCR247肽通过抑制翻译阻止了蒺藜苜蓿根瘤菌(E. meliloti)的增殖,并改变转录和翻译的谱系,导致根瘤菌的分化。其他一些M. truncatula的NCRs在体外也具有抗菌活性,并且对于根瘤菌的发展和持久性是必需的。为了减弱NCRs对细菌生长抑制的影响,E. meliloti具有两种可能的机制:(a)通过HrrP(host range restriction peptidase)降解NCRs;(b)运输NCRs以减少其细胞毒性或将其从细菌细胞表面移除。根据NCR和富含甘氨酸蛋白(GRP)之间的相似性,GRP肽也可能在根瘤菌的终端分化中起作用。
3.2 小RNA
除了在植物体内的植物免疫信号调控作用,小RNA已被证明可以直接抑制病毒和真核病原体。Singla-Rastogi等人的结果发现,拟南芥编码的反向重复转基因(Arabidopsis-encoded inverted repeat transgenes)触发了P. syringae 内源性毒力基因的沉默。这种沉默效应与毒力下降相关,表明植物来源的小RNA也可能直接抑制细菌毒力。
3.3 活性氧(ROS)
植物在响应各种生物和非生物胁迫时会诱导活性氧(ROS)的产生以适应这些胁迫。在PRR激活后,质膜定位的NADPH氧化酶RBOHD(RESPIRATORY BURST OXIDASE HOMOLOG D)产生ROS O2。-,并迅速在质外体中转化为H2O2。尽管细胞外ROS可以对微生物产生细胞毒性,但缺乏直接证据表明ROS在植物中抑制细菌病原体的毒性作用。最近研究表明,RBOHD介导的ROS生产直接抑制了黄单胞菌Xanthomonas的II型分泌系统(T2SS),这种分泌系统在细胞壁降解和其他细胞过程中起作用,从而使Xanthomonas在拟南芥中失去致病性。这种黄单胞菌的定殖保护植物免受P. syringae 的侵害。因此,植物来源的ROS驯服了潜在的有害细菌,使其转变为有益细菌。
3.4 植物激素
在拟南芥叶片中,迪基氏菌Dickeya dadantii的感染触发了茉莉酸(JA)的生产。D. dadantii通过JA的趋化受体感知JA,并被JA吸引。一致地,JA产生缺陷的拟南芥突变植物对通过伤口进入的细菌更具抗性,表明JA感知促进了细菌的侵入。JA和甲基茉莉酸(MeJA)也直接影响从土壤中分离出的链霉菌的生长、发育和代谢。这表明除了在防御信号激活中的作用外,JA还可以直接调节细菌的生长和行为。
吲哚-3-乙酸(IAA)是最常见的天然存在的生长素,是植物生长和发育的关键分子。恶臭假单胞菌Pseudomonas putida基于MCP趋化受体PcpI的活性被IAA吸引。类似的,乙烯是一种调节生长和发育以及防御的气态植物激素,吸引了许多假单胞菌,包括荧光假单胞菌P. fluorescens、恶臭假单胞菌P. putida和丁香假单胞菌P. syringae。因此,这些植物激素是假单胞菌的趋化性物质。与此一致的是,植物来源的IAA依赖和独立于IAA介导的SA信号抑制,促进丁香假单胞菌的生长,这是对抗丁香假单胞菌的有效防御。P. syringae 也生产IAA,这种细菌生产的IAA促进其毒力。体外IAA处理调节了P. syringae 的700多个基因,包括抑制T3SS基因。因此,植物和细菌产生的IAA是植物和细菌中的信号分子,并以复杂的方式调节植物-细菌相互作用。
除了作为防御信号分子的既定作用外,SA还可以直接抑制包括假单胞菌Pseudomonas,农杆菌Agrobacterium和腐霉菌Pectobacterium在内的细菌病原体的毒力基因表达。在SA缺乏的拟南芥植物中,P. syringae的T3SS蛋白积累增加,尽管SA是否直接在植物中抑制细菌病原体仍不清楚。
细胞分裂素是调节植物生长、发育以及防御病原体的植物激素。有趣的是,黄单胞菌X. campestris通过膜结合的组氨酸激酶PcrK感知植物来源的细胞分裂素2-异戊烯基腺嘌呤,从而促进毒力。P. syringae 也生产细胞分裂素,并且是其拥有毒力是必需的。相反,荧光假单胞菌P. fluorescens生产的细胞分裂素通过激活SA信号保护拟南芥免受P. syringae 的感染。
3.5 特化代谢产物
植物多酚可以通过靶向调控T3SS基因的双组分调节系统来抑制细菌毒力。例如,拟南芥中的一种双组分系统可以直接被单宁酸、12,3,4,6-五没食子酰葡萄糖(1,2,3,4,6-pentagalloylglucose)和表没食子儿茶素没食子酸酯(epigallocatechin gallate)等多酚靶向,从而抑制P. syringae 的T3SS。因此,植物可以通过多酚来解除P. syringae 的武装。黄酮类化合物是陆生植物和藻类中广泛存在的多酚,在植物发育、胁迫响应和植物-微生物相互作用中起关键作用。豆科植物产生的黄酮类化合物会触发其共生根瘤菌中共生基因(亦称为结瘤基因,nod基因)的表达。适应大豆的P. syringae 传递T3SS效应蛋白HopZ1,靶向催化异黄酮类多酚甘油醇合成的2-羟基异黄酮脱水酶,从而减少甘油苷的积累并增加P. syringae 的生长。
硫代葡萄糖苷(Glucosinolates)是十字花目植物中产生的富含硫的阴离子特化代谢产物,通过内源性硫代糖苷酶(也被称为芥子酶[myrosinases])活化成多种在植物-微生物和植物-昆虫相互作用中起关键作用的化合物。一些硫代葡萄糖苷的分解产物如萝卜硫素(4-甲基亚磺酰基丁基异硫氰酸酯,SFN)在体外具有潜在的抗菌活性并抑制P. syringae 和X. campestris的毒力因子。例如,SFN通过直接结合抑制P. syringae 的HrpS,从而降低其毒力。一些P. syringae 拥有可以存活在拟南芥提取物中的基因(survival in Arabidopsis extracts,Sax),这些基因可以解毒并排出SFN。有趣的是,用于SFN降解的SaxA的同源基因存在于感染十字花科植物的腐霉菌Pectobacterium中。将SaxA转入可以感染马铃薯的Pectobacterium可以使其感染十字花科植物,表明SFN决定了Pectobacterium的宿主范围。
香豆素(Coumarins)是通过苯丙氨酸途径在广泛的被子植物中合成的植物特化代谢物,具有铁动员和抗菌活性。在拟南芥中,铁缺乏诱导香豆素的生物合成和分泌,如包括东莨菪内酯(scopoletin)、fraxetin和sideretin。香豆素的生物合成受转录因子MYB72和Feruloyl-CoA 6'-羟化酶1(F6'H1)调控,其分泌需要BGLU42葡糖苷酶和ABCG37转运蛋白。MYB72和BLGU42对有益根际细菌诱导的系统抗性至关重要。香豆素在高浓度下对P. syringae 和R. solanacearum在体外具有抗菌活性,尽管香豆素在植物中对这些病原体的抗菌活性仍有争议。
亚麻荠素(Camalexin)是一种由色氨酸衍生的吲哚类植保素,在十字花科植物中产生,对植物抵抗真菌病原体起关键作用。尽管高浓度亚麻荠素处理可在体外破坏了P. syringae 的细胞膜,但拟南芥中亚麻荠素生物合成的基因突变并不改变对P. syringae 的易感性,而亚麻荠素前体dihydrocamalexic acid似乎抑制P. syringae 的生长。有趣的是,亚麻荠素影响Pseudomonas CH267的植物生长促进作用,而不影响其定殖能力。亚麻荠素缺陷的拟南芥无法促进CH267的生长,这可以通过补充亚麻荠素来补偿。CH267定殖后,亚麻荠素在根和根分泌物中的积累增加,但细菌病原体伯克霍尔德菌Burkholderia glumae触发了更高的亚麻荠素产生和分泌。亚麻荠素仅在某些浓度下支持CH267的生长促进作用。这提出了一种假设,即亚麻荠素在低浓度下调节某些细菌的代谢活动,而在高浓度下则表现出毒性,植物通过改变亚麻荠素的分泌水平来区别调节不同的细菌。
4 植物代谢产物对微生物群的调控
植物拥有分类学结构化的细菌群落,这表明植物选择性地招募或排斥特定细菌。最新的结果表明,植物分泌的专属代谢物和其他分子可以选择性地支持或抑制某些细菌的生长,从而招募特定的微生物群(图2)。
4.1 特化代谢产物
植物专属代谢物在植物-微生物相互作用中起着关键作用,特别是在选择植物相关微生物和组装微生物群方面。
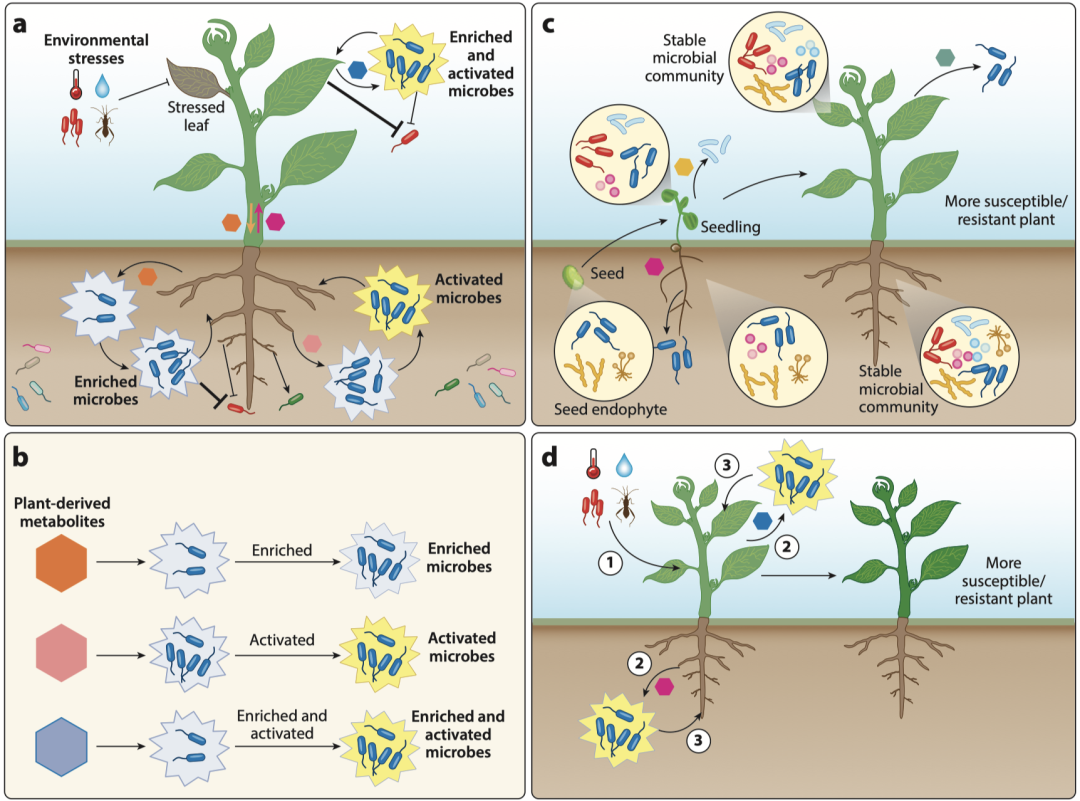
图2 植物对微生物的选择性调控。(a) 植物如何选择性地招募和抑制微生物群落及影响其活性的机制概览。箭头和线条的粗细代表支持或抑制的不同强度。(b) 微生物利用植物来源的代谢物质,导致它们的富集和激活,从而促进功能性反应。(c) 在生长阶段,宿主植物持续塑造其微生物群,组建一个稳定的微生物群落,这使得植物更易受感染或更具抵抗力。(d) 在受到压力时,宿主植物招募并激活特定的微生物,这可能有助于防御,或者在环境阈值超过植物调控能力的情况下,无意中促进病原体感染或加速植物死亡。
4.1.1 苯并噁嗪类化合物
苯并噁嗪类化合物(Benzoxazinoids,BXs)是从色氨酸衍生的特化代谢物,主要在禾本科植物中产生,但也存在于一些双子叶植物中,具有多种作用。它们对微生物、线虫和昆虫表现出杀生物活性,影响微生物行为,并激活植物防御反应。Hu等人阐明了BXs对植物微生物群的影响,特别是对根和根际真菌和细菌群落的影响。种植在产生BXs玉米植物处理过的土壤中的玉米植物表现出较高的抗虫性和较低的生长速度,而与BXs缺乏的玉米植物处理过的植物相比,这种土壤调节效果取决于土壤微生物,因为土壤灭菌会使这种效果消失。BXs的分解产物6-甲氧基苯并噁唑-2-酮(MBOA)是这种BXs介导的土壤调节的主要因素。BXs及其衍生物还作为植物信号分子,刺激各种土壤调节根代谢物的生产,特别是黄酮类化合物,通过促进嗜甲基菌科(Methylophilaceae)细菌和抑制微球菌科(Micrococcaceae)细菌来调节土壤微生物群落。BXs对微生物群的影响还扩展到玉米茎部。最近的一项研究表明,分离自玉米根的细菌菌株在BXs耐受性的差异与细菌细胞壁结构有关,解释了某些细菌在根中的丰度。分离自玉米根的细菌比分离自拟南芥的细菌表现出更大的耐受性。这些发现共同强调了BXs选择性地影响不同细菌,从而构建植物微生物群并促进植物健康。
4.1.2 亚麻荠素
新兴证据表明,从根部分泌的亚麻荠素会影响根部细菌群落的结构,并调节根相关的促生细菌的功能。使用30株合成细菌群落的SEER-FISH显示,亚麻荠素处理影响了拟南芥根部细菌定殖的空间分布。例如,亚麻荠素减少了中华根瘤菌(Sinorhizobium)和裂殖假单胞菌(Lysobacter)的定殖,而增加了农杆菌(Agrobacterium)、红杆菌(Rhodanobacter)和假单胞菌(Pseudomonas)在根尖的定殖。此外,亚麻荠素增加了酸克雷伯菌(Acidovorax)和节杆菌(Arthrobacter)之间的空间关联,表明亚麻荠素不仅影响细菌定殖,还影响细菌-细菌相互作用。这些细株对亚麻荠素的体外敏感性并不能完全解释亚麻荠素在植物中的细菌定殖影响,这表明亚麻荠素影响细菌定殖和相互作用的机制尚待进一步研究。
4.1.3 香豆素
多项研究表明,香豆素在铁限制条件下塑造根部细菌群落的结构,例如拟南芥f6′h1突变体植物的根部细菌群落与野生型植物不同。这种细菌群落的变化是由于缺乏香豆素的生物合成,而不是植物铁稳态受损,因为表现出严重铁缺乏但香豆素生物合成完整的拟南芥突变植物与野生型植物的根部细菌群落相似。体外实验表明, 东莨菪内酯(scopoletin)和fraxetin(均属于香豆素)选择性地抑制某些细菌的生长,具有菌株特异性。daphnetin 和fraxetin刺激铁限制Pseudomonas的生长。因此,香豆素可以支持或抑制特定细菌。这种对香豆素的菌株特异性敏感性可能解释了香豆素缺乏植物根部细菌群落的变化。有趣的是,促进植物生长并从根到茎诱导系统免疫假单胞菌的Pseudomonas simiae WCS417和假单胞菌Pseudomonas capeferrum WCS358对东莨菪内酯具有耐受性,表明植物选择性地排斥某些细菌,但不排斥对植物有益的细菌。一致地,合成细菌群落以及单一细菌菌株通过缓解植物铁饥饿来促进植物生长,这需要植物的香豆素生物合成。在铁限制的土壤中生长的f6′h1突变体中,微生物群介导的生长促进缺陷通过补充fraxetin而非东莨菪内酯得到恢复,表明香豆素之间具有特异性。此外,研究表明香豆素生物合成对于土壤遗传效应是必需的。拟南芥被卵菌病原体Hyaloperonospora arabidopsidis(Hpa)感染改变了根际微生物群的结构。随后种植在由病原体感染植物调节的土壤中的拟南芥表现出对Hpa的增强抗性。有趣的是,香豆素生物合成是这种土壤遗传效应所需的,这有助于后代植物通过SA生物合成提高对Hpa的抗性。香豆素如何影响细菌活性尚不清楚,但已经进行了一些努力来理解这一点。对在野生型或香豆素生物合成突变植物的根部分泌物中生长的假单胞菌P. simiae WCS417进行的转录组比较表明,香豆素诱导了WCS417基因与碳水化合物、氨基酸和核苷酸的运输和代谢相关的基因,同时抑制与细菌运动性相关的基因,表明香豆素调节特定细菌的代谢。
4.1.4 黄酮类化合物
关于拟南芥突变体的研究表明,尽管黄酮类化合物缺乏不会显著影响在水环境中与合成细菌群落的根部关联,但增加的黄酮类化合物生产吸引了气单胞菌科(Aeromonadaceae)细菌到根部,从而增强植物的抗脱水性。同样,玉米根部产生的黄酮类化合物通过增加根际中的草酸杆菌科(Oxalobacteraceae)的丰度来促进生长和氮的吸收。在番茄-马铃薯-洋葱间作系统中,马铃薯-洋葱根部代谢物,特别是黄酮类化合物花旗松素(taxifolin),改变了番茄根部代谢物,从而诱导番茄招募有益细菌如枯草芽孢杆菌,这些细菌保护番茄免受土传真菌病原体黄萎病菌的侵害。番茄中的成熟抑制基因(RIPENING-INHIBITOR,RIN)通过改变根部分泌物,特别是核黄素(riboflavin)和3-羟黄酮(3-hydroxyflavone),影响微生物群介导的抗病性,这些物质招募了链霉菌(Streptomyces)来抑制R. solanacearum。应用3-羟基黄酮和核黄素恢复了rin突变体中的微生物组成、多样性和抑制性,表明黄酮类化合物在组装有益微生物群中的作用。
4.1.5 硫代葡萄糖苷
早期研究表明,硫代葡萄糖苷及其衍生物改变了拟南芥和油菜植物根际和根部细菌群落的结构。对生产硫代葡萄糖苷不同的芜菁重组自交系的分析表明,不同硫代葡萄糖苷的水平与某些细菌属如金黄杆菌属(Chryseobacterium),恶臭假单胞菌属(Stenotrophomonas) ,土地杆菌属(Pedobacter),假单胞菌属(Pseudomonas),叶杆菌属(Phyllobacterium),拟节杆菌(Paenarthrobacter)的相对丰度呈正相关或负相关。同样,具有不同硫苷生产能力的拟南芥突变体显示出不同的根际细菌群落。此外,不同硫代葡萄糖苷对叶部细菌群落具有独特的影响。不同细菌在含有硫苷或叶片提取物的体外生长实验表明,不同硫代葡萄糖苷支持或抑制某些细菌。特别是,烯丙基硫代葡萄糖苷在体外作为碳源支持伯克霍尔德菌目(Burkholderiales)的生长,并在植物中富集。Burkholderiales的丰富依赖于其他细菌,这表明硫代葡萄糖苷通过支持Burkholderiales与其他细菌共同影响叶部细菌群落。有趣的是,植物来源的硫代葡萄糖苷还影响人类和鸟类的肠道细菌群落,表明硫苷对植物-细菌相互作用之外的影响。
4.1.6 萜类化合物
萜类化合物是具有五碳异戊二烯单位的多达80,000种特化代谢物,在所有植物中广泛存在,在植物环境适应和植物-微生物相互作用中起关键作用。研究表明,它们对内生细菌具有选择性调控作用,一些细菌菌株在高浓度下表现出增强的生长,而其他细菌则表现出双相反应。葫芦素B(Cucurbitacin B)是葫芦科植物中特有的苦味三萜类化合物,从甜瓜根部分泌到土壤中,通过选择性富集两种细菌属,即肠杆菌属(Enterobacter)和芽孢杆菌属(Bacillus),来调节根际微生物群,从而对土传枯萎病病原真菌镰刀菌表现出强大的抗性。在拟南芥中,专属三萜类化合物的生物合成显著影响根特异性细菌,有助于组装和维持独特的根部微生物群。两种根特异性五环三萜类化合物也调节根部微生物群。与萜类化合物的选择性一致,三萜类化合物选择性支持有益细菌P. simiae WCS417的定殖,而不支持病原菌R. solanacearum的定殖,这表明三萜类化合物可能帮助植物区分有益和致病细菌。
4.1.7 植物激素
尽管植物激素的生物合成和信号传导被证明会影响植物微生物群的结构,但植物激素是否直接影响微生物群仍然大多未知。然而,有证据表明植物来源的植物激素直接影响植物微生物群。例如,SA支持Terracoccus和Streptomyces的体外生长,并抑制Mitsuaria。对细菌的这种选择性支持或抑制可能解释了SA对根相关细菌群落的影响。根相关细菌触发植物挥发性有机化合物(VOCs)的释放。VOCs诱导邻近番茄植物根部分泌物中大量SA的释放,这与邻近植物根部细菌群落的变化有关。有趣的是,SA的衍生物水杨酸甲酯增加了番茄根际细菌的总丰度。这些结果表明植物来源的SA可以直接调节植物微生物群。一项使用12种不同JA含量的玉米基因型的研究表明,JA水平与特定细菌分类群的丰度呈正相关或负相关。此外,最近的一项研究表明,一种主要的根挥发性化合物MeJA迅速触发生物膜的形成并改变微生物群的组成。由MeJA诱导的生物膜细菌群落从远处促进植物生长。因此,植物来源的JA可以直接影响细菌群落的结构并调节其活性以促进植物健康。此外,对花生-木薯间作系统的研究表明,木薯生产的氰化物触发花生根部的乙烯产生,导致花生根际Catenulispora丰度选择性增加,从而增强花生植物的养分矿化。
4.2 其他分子
植物的粘液主要由高分子量化合物组成的富含多糖的粘弹性凝胶基质构成,几乎存在于所有植物中。气生根的粘液富集固氮细菌,从而促进玉米和高粱植物的大气氮固定,尽管这些固氮细菌对氮固定活性的直接因果关系尚不明确。在藤蔓植物蔓性野牡丹(Heterotis rotundifolia)中,气生根-粘液系统为固氮细菌和真菌Chaetomella raphigera提供了生态位,后者保护宿主免受病原微生物的侵害而不抑制固氮细菌。但是,植物产生的粘液如何特异性地富集固氮细菌仍然未知。
全基因组关联研究(GWAS)发现泛菌属(Pantoea)和链霉菌属(Streptomyces)的丰度与特定宿主基因相关:编码液泡定位的肌醇转运蛋白的INT1基因和负责运输各种多元醇和单糖的PMT5基因。相应地,缺乏这些基因的拟南芥突变体表现出泛菌属(Pantoea)和链霉菌属(Streptomyces)的定殖减少。另一项研究表明,肌醇的存在通过编码肌醇代谢的iol基因簇增强细菌的游泳运动能力和铁载体的积累,并改变菌落形态。
在响应P. syringae 时,拟南芥根部分泌氨基酸和长链有机酸,这些分泌物调节后代植物的根际微生物群并增强病害抑制。一项研究表明,与枯萎病相关的根际微生物群与植物代谢物生育酚乙酸酯(tocopherol acetate)、瓜氨酸(citrulline)、半乳糖醇(galactitol)、十八醇(octadecylglycerol)和二十二碳酸(behenic acid)相关。这些代谢物的应用导致根部微生物群的变化,并增加西瓜对枯萎病的易感性。此外,代谢调节对Bradyrhizobium,Streptomyces,Variovorax,Pseudomonas和Sphingomonas的自毒降解产生不利影响,表明这些特定的代谢物在通过抑制细菌自毒降解来塑造病态根际微生物群的组装中起关键作用。
对110个水稻种质资源的叶片微生物组的GWAS研究将细菌丰度与水稻基因组中的单核苷酸多态性(SNP)联系起来。水稻基因OsPAL02合成的4-羟基肉桂酸(4-HCA)是富集假单胞菌目(Pseudomonadales)细菌的关键驱动因素。OsPAL02的敲除导致叶片微生物群失调,与假单胞菌目(Pseudomonadales)减少和对病原体的易感性增加有关。
使用无菌系统和合成的叶片细菌群落,研究人员发现RBOHD介导的ROS阻止了黄单胞菌(Xanthomonas)在拟南芥叶片微生物群中的失调。随后的研究表明,缺乏RBOHD的拟南芥植物中的微生物群失调是由于黄单胞菌(Xanthomonas)T2SS依赖的酶分泌活性增强。在拟南芥根部,FERONIA(FER)受体激酶促进ROS产生。FER和RBOHD缺乏的突变植物在根际富集假单胞菌。总体而言,RBOHD介导的ROS调节了特定细菌在叶片和根际微生物群中的活性和丰度。
展望
综上所述,越来越多的证据表明,植物产生的防御分子选择性地调节不同细菌的生长和行为。然而,在大多数情况下,我们仍然缺乏关于它们如何在分子水平上影响细菌的知识。我们仍然不知道植物如何选择性地招募或排斥不同的细菌。植物的先天免疫系统由PTI和ETI组成,可以分为三个步骤:通过受体识别微生物、信号在植物内的传导以及执行。与过去三十年在前两个步骤上的重大进展相比,我们对第三步的了解还很有限。
植物在自然界中需要细菌生存,但有些细菌对宿主植物有害。这是植物面临的一个巨大困境,因为植物不能简单地接受或杀死所有这些细菌。植物应对这种困境的一种可能方式是,它们具有足够的能力来区分朋友和敌人。尽管如上所述,植物在一定程度上可以做到这一点,但植物并不总是能够区分对它们有益或有害的细菌,因为朋友和敌人常常相似,并且细菌的特性会根据环境变化。另一种选择是植物选择性地靶向与病原体相关的细菌毒力成分。通过这样做,植物并不简单地消灭细菌,而是将潜在的敌人驯服为朋友。无论如何,要真正理解植物免疫系统和植物-细菌相互作用,需要更大努力。
在自然界中,植物通过改变其分子组成和浓度来适应环境,以适应并与其微生物朋友合作,同时抑制敌人(图2a)。从更广泛的范围来看,受植物基因型、驯化和生长阶段影响的宿主植物微生物组组成的变化反映了对环境的适应。微生物对植物来源分子的反应各不相同,有些微生物被富集和/或激活以为宿主植物提供特定服务(图2b)。植物与其微生物群的相互作用是动态的。在生长过程中,宿主植物通过分泌影响其抗各种胁迫的代谢物来不断塑造其微生物群(图2c)。在病原体感染或非生物胁迫等压力条件下,植物微生物群通过改变微生物丰度或激活特定微生物来调节其微生物群,这些微生物可以抵抗或促进病原体感染(图2d)。植物-微生物相互作用的复杂动态不仅对即时胁迫响应至关重要,还在植物的进化成功中发挥了重要作用。据推测,植物在进化时期的生态成功取决于它们在根际和叶际招募合作微生物的能力。尽管正在进行研究,但植物选择促进植物健康的微生物群的确切机制仍然未知。理解这一过程有助于通过部署定制的微生物群或调节局部微生物群落来发展可持续农业。
华中农业大学博士后Satoru Nakagami与硕士生汪哲为本文的共同第一作者,华中农业大学Kenichi Tsuda 教授为本文的通讯作者,华中农业大学韩晓伟教授参与了本研究。
本文参与 腾讯云自媒体同步曝光计划,分享自微信公众号。
原始发表:2024-07-03,如有侵权请联系 cloudcommunity@tencent.com 删除
评论
登录后参与评论
推荐阅读

